- +1
人類腸道癌癥精準治療的新希望:可視化微米機器人
編輯│陳圓圓
審校│湯紅明
【據《Science Robotics》2019年7月報道】題:基于光聲斷層成像技術實時控制微型機器人在體內腸道定向導航(作者Zhiguang Wu等)
隨著納米技術的發展,醫療機器人應運而生并不斷趨于微型化。其中微/納米級機器人以其尺寸小、穿透深、可載藥等獨特優勢引起廣泛關注,有望實現疾病診斷、靶向藥物遞送及精準微創手術等生物醫學應用。然而,由于缺乏高分辨率的實時影像導航及控制手段,微納機器人在機體深部進行實時監測定位、可控自主運動仍然是一大挑戰和難題。因此,迫切需要一種能精確控制、靶向運動、滯留時間長且可持續釋藥的微型藥物遞送系統。
來自美國加州理工學院的Zhiguang Wu等近期有了可喜的新發現,他們構建了金包裹的Mg基腸道微米機器人,通過光聲斷層成像技術(PACT)引導,可以在體內實現實時影像監測、精確運動控制和藥物靶向遞送。在動物腸癌模型的治療研究中,使用該機器人已取得較好的治療效果。
這項研究主要解決了微米機器人在生物醫學應用的兩大難題:
一是成像,通過引入 PACT,研究者可實時追蹤微米機器人在胃腸道中的位置,實現高分辨率和高對比度的光聲成像和定位;
二是控制,一旦微米機器人到達腫瘤區域,連續近紅外輻照可快速觸發機器人自主運動開關,并激活噴氣推動,雙重控制其定向運動、黏附至腫瘤周圍組織釋藥,有效延長了微米機器人在腸道中的滯留時間并提高藥物釋放精準性。
結合微米機器人與PACT兩大新興前沿技術,使機器人在體內能進行深層組織實時成像和精確控制,在生物醫學應用中顯示出巨大潛力和應用價值。
具體來說,微米機器人主體為鎂金屬球(直徑約20μm),表面鍍了一層薄薄的金屬金和聚對二甲苯(抵抗胃酸消化),其間夾載抗腫瘤藥物DOX構成復合微米機器人載藥系統(如圖)。鎂金屬球表面留有圓形區域未被鍍層覆蓋,這部分裸露的金屬鎂在腸道中發生鎂-水反應產生氣泡,推動微球前進,直到碰撞周圍組織后停滯,有效提高了滯留時間和藥物釋放效率。此外,為了保護微米機器人免受胃部惡劣酸性環境的影響,將其封裝在石蠟制成的微膠囊(MCs)中,當MCs到達病灶時施以連續近紅外輻照,僅需0.1s由金引發的光熱效應即可觸發膠體相變引起MCs崩解進而釋放微米機器人。這種可控性強、高效推進的激活方法為微米機器人提供了與靶向組織結合的機械驅動力,從而達到定點釋放藥物和延長滯留時間的目的,提高了治療效果。
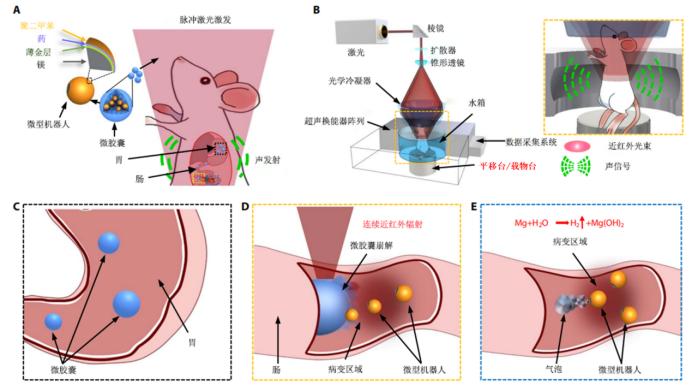
PACT可在深度7cm的組織內,對微米機器人進行高空間分辨率、高分子對比度的實時成像,實現深度追蹤和精確定位。目前,PACT因其非入侵式、穿透深、高分辨率、高對比度等優點,廣泛用于生物醫學領域。在光聲成像過程中,特定波長的激光照射生物組織,組織內發色團吸收的光子能量可轉換為超聲信號,隨后被檢測出形成具有高光學對比度和高分辨率的斷層掃描圖像。可以說PACT完美結合了光學成像的高選擇性和超聲成像的穿透深等優點,克服了傳統光學成像在深層組織受光散射的阻礙,突破深度“軟”極限(~1mm),實現高時空分辨率的深度成像;同時利用生物組織對光譜高選擇性吸收的差異,能夠實現高特異性、高對比度的分子水平成像。憑借以上優勢,PACT有望在機體內實時監測、精準控制微米機器人,實現人體深層病灶如胃腸道腫瘤等疾病的靶向遞藥和精準治療。
盡管目前PACT引導的微米機器人治療效果已在小動物身上體現,但人類深部疾病可能需要數十厘米的組織穿透深度,而PACT因受光耗散限制只能提供最多7cm的組織穿透力,仍然是臨床治療的瓶頸。
小小機器人可以實現在人體胃腸道中實時成像、靶向遞藥和自主運動,這為下一代智能微納機器人系統的研發、深部疾病的高精度微創治療提供了新思路。同時,也給未來醫學發展提供新的啟示,微納機器人研究的快速進步,尤其與先進的成像技術結合,不僅能從微觀角度、分子水平進行疾病的診療,即使對單個細胞也能實現可視化精確操作,可為攻克腫瘤、血栓等機體深部疾病診療的難關提供新的機會和可能。
(本文來源于《醫學參考報》干細胞與再生醫學頻道2020-01期第6版文章,ID:yxckbsc2020010602,圖片來源于網絡,如有侵權,請聯系刪除。)
《醫學參考報》干細胞與再生醫學頻道
由同濟大學附屬東方醫院承辦
本文為澎湃號作者或機構在澎湃新聞上傳并發布,僅代表該作者或機構觀點,不代表澎湃新聞的觀點或立場,澎湃新聞僅提供信息發布平臺。申請澎湃號請用電腦訪問http://renzheng.thepaper.cn。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2024 上海東方報業有限公司




