- +1
甘波誼團隊首次發(fā)現(xiàn)放療會誘導(dǎo)癌細(xì)胞銅死亡,提出破解癌癥放療抵抗新思路
原創(chuàng) 生物世界
撰文丨王聰
編輯丨王多魚
排版丨水成文
放療(Radiotherapy,RT)是多種癌癥治療的重要基石。放療會誘導(dǎo) DNA 雙鏈斷裂,并產(chǎn)生自由基,損害其他生物分子(例如脂質(zhì)和蛋白質(zhì))。這種多方面的攻擊會導(dǎo)致細(xì)胞周期停滯、衰老、有絲分裂災(zāi)難以及不同形式的受控細(xì)胞死亡(RCD),從而在癌癥治療中顯著增強腫瘤抑制作用。盡管放療效果顯著,但由于輻射抵抗的挑戰(zhàn),其在所有腫瘤中的治療效果并不一致。輻射抵抗的關(guān)鍵機制包括對 RCD 的抑制。因此,了解放療激活的 RCD 通路可能為克服癌癥治療中的輻射抵抗提供關(guān)鍵見解。
一開始的研究主要集中于放療引發(fā)的細(xì)胞凋亡(Apoptosis),而近期的一些研究顯示,放療能夠誘導(dǎo)癌細(xì)胞發(fā)生另一種受控細(xì)胞死亡方式——鐵死亡(Ferroptosis)。這表明放療可能在激活其他細(xì)胞死亡方式中發(fā)揮潛在作用,銅死亡(Cuproptosis)作為一種新發(fā)現(xiàn)的受控細(xì)胞死亡方式,尤其值得關(guān)注。
2025 年 4 月 10 日,MD 安德森癌癥中心甘波誼教授團隊(雷光博士、孫明闖博士和程軍博士為共同第一作者)在 Cancer Cell 期刊發(fā)表了題為:Radiotherapy promotes cuproptosis and synergizes with cuproptosis inducers to overcome tumor radioresistance 的研究論文。
該研究首次發(fā)現(xiàn)放療通過激活銅死亡殺傷癌細(xì)胞,并解析了具體機制——放療通過上調(diào)銅轉(zhuǎn)運蛋白-1 (CTR1)以及消耗線粒體中銅螯合蛋白谷胱甘肽(GSH)來提高線粒體中的銅水平,從而引發(fā)銅死亡。進而開創(chuàng)性地提出了銅離子載體聯(lián)合放療來逆轉(zhuǎn)腫瘤的放療抵抗,這些發(fā)現(xiàn)為破解腫瘤放療抵抗提供了全新思路。

甘波誼教授
放療通過高能輻射破壞癌細(xì)胞的 DNA,但狡猾的癌細(xì)胞會通過多種途徑來抵抗放療,包括修復(fù) DNA 損傷、激活抗氧化防御、關(guān)閉細(xì)胞凋亡程序等。傳統(tǒng)觀點認(rèn)為,放療主要造成癌細(xì)胞發(fā)生凋亡,但越來越多的證據(jù)表明,其他細(xì)胞死亡形式(例如鐵死亡)也參與其中。而這項最新研究首次發(fā)現(xiàn),一種新型死亡方式——銅死亡(Cuproptosis),在放療療效中發(fā)揮著關(guān)鍵角色。
什么是“銅死亡”?
銅是從細(xì)菌和真菌到植物、動物以及人類生命活動的基本元素,作為必需酶的輔助因子,在生命活動中發(fā)揮著必不可少的作用。銅在人體中是一種微量元素,細(xì)胞內(nèi)銅離子的濃度通過主動穩(wěn)態(tài)機制保持在非常低的水平,一旦超過閾值,銅就會變得有毒,導(dǎo)致細(xì)胞死亡。
2022 年,哈佛-MIT博德研究所 Todd Golub 教授團隊在 Science 期刊發(fā)表論文。發(fā)現(xiàn)并證實銅依賴性受控細(xì)胞死亡方式是一種不同于已知細(xì)胞死亡機制的新型細(xì)胞死亡方式——銅死亡(Cuprotosis)。
銅死亡的觸發(fā)條件是線粒體內(nèi)銅離子過量堆積,致死機制是銅離子結(jié)合脂酰化蛋白(例如DLAT),破壞線粒體代謝酶,引發(fā)“蛋白質(zhì)災(zāi)難”,關(guān)鍵標(biāo)志是脂酰化蛋白寡聚化、鐵硫簇蛋白(FDX1/LIAS)降解。
放療激活銅死亡
在這項最新研究中,研究團隊通過細(xì)胞實驗、動物模型和癌癥患者樣本分析,發(fā)現(xiàn)放療通過雙重機制引發(fā)銅死亡:
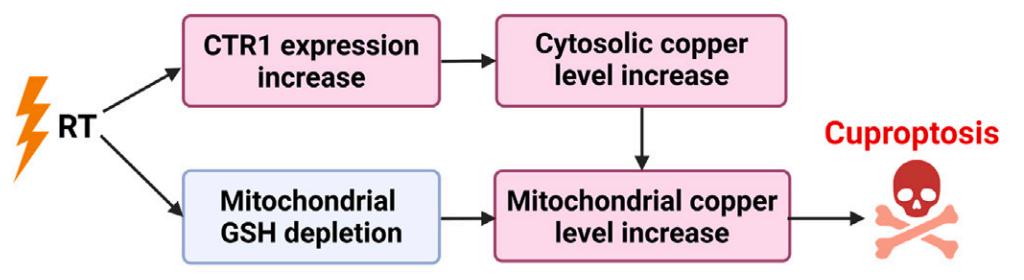
1、打開銅吸收通道:通過上調(diào)銅轉(zhuǎn)運蛋白 CTR1,促進癌細(xì)胞攝取銅離子;
2、解除銅封印:耗竭線粒體谷胱甘肽(天然銅螯合劑),釋放蓄積的銅離子;
因此,放療通過上調(diào)銅轉(zhuǎn)運蛋白 CTR1 以及耗竭線粒體谷胱甘肽(GSH),提高線粒體內(nèi)銅水平,引發(fā)銅死亡。
放療抵抗的根源:銅死亡機制失靈
通過對放療不敏感的腫瘤進行研究,研究團隊發(fā)現(xiàn)其中的關(guān)鍵改變——BACH1 蛋白缺失,導(dǎo)致金屬硫蛋白 MT1E/X 過度表達,而 MT1E/X 蛋白能夠像“海綿吸水”一樣結(jié)合銅離子,阻止線粒體銅蓄積。這解釋了為何部分腫瘤對放療不敏感——它們進化出了“銅緩沖系統(tǒng)”,面對放療,難以提高銅水平,因此難以發(fā)生銅死亡。
利用銅離子載體破解放療抵抗
在上述發(fā)現(xiàn)的基礎(chǔ)上,研究團隊提出創(chuàng)新療法:使用銅離子載體 Elesclomol,促進外源銅離子進入細(xì)胞,誘導(dǎo)銅死亡,能夠顯著增強放療抵抗的癌細(xì)胞,細(xì)胞系來源的異種移植瘤,以及患者來源的異種移植瘤對放療的敏感性,大幅縮小腫瘤體積,顯著提高腫瘤小鼠模型生存期。更令人振奮的是,該方法在正常組織中耐受性良好,未出現(xiàn)明顯毒副作用。
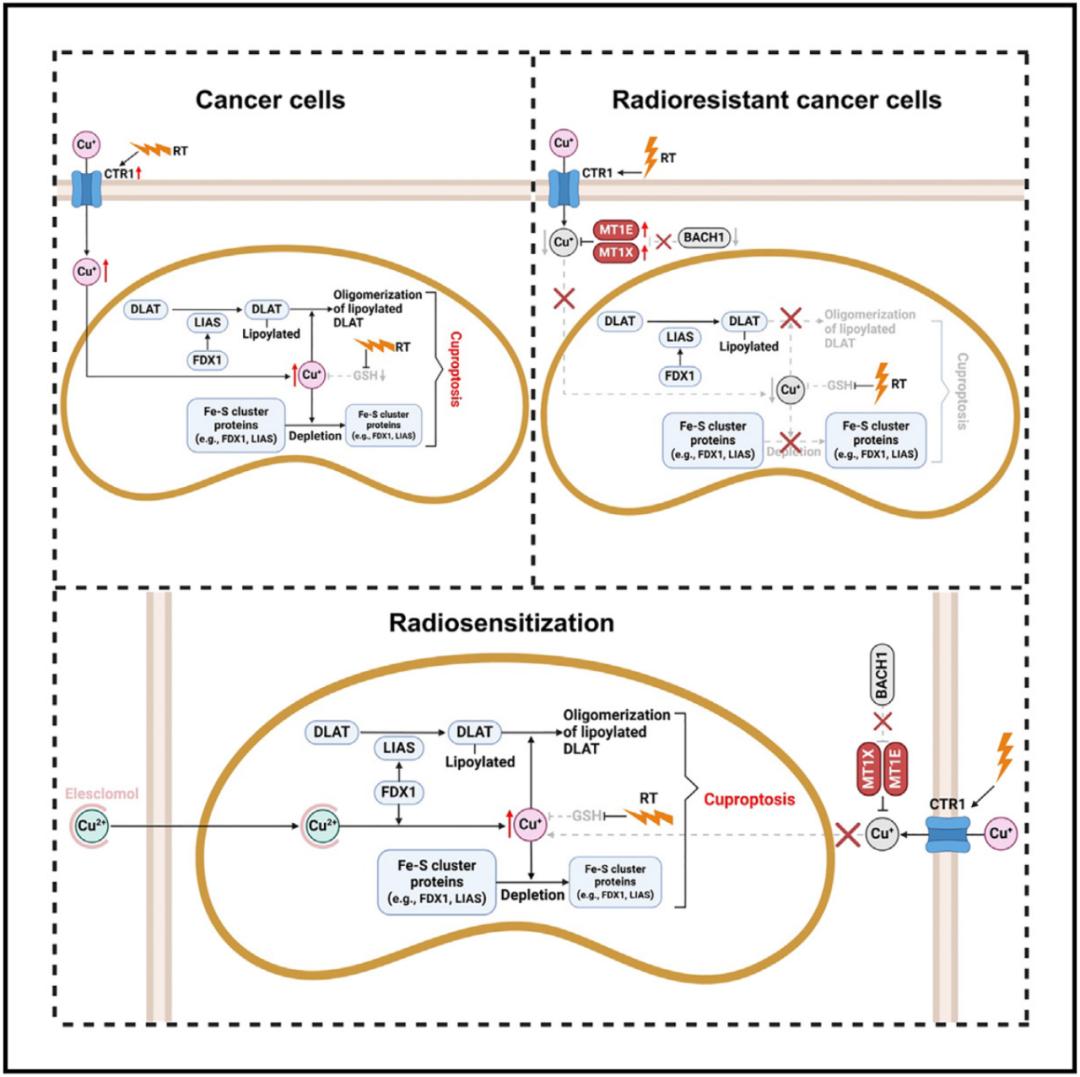
總的來說,這項研究讓我們對放療的抗癌作用有了全新認(rèn)知,揭示了放療與銅死亡之間的聯(lián)系,從而揭示了腫瘤的放療抵抗的深層原因,并提供了“精準(zhǔn)激活銅死亡”的創(chuàng)新療法,通過靶向銅死亡,破解腫瘤的放療抵抗,為放療抵抗的腫瘤治療提供全新思路。
論文鏈接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(25)00132-1
為促進前沿研究的傳播和交流,我們組建了多個專業(yè)交流群,長按下方二維碼,即可添加小編微信進群,由于申請人數(shù)較多,添加微信時請備注:學(xué)校/專業(yè)/姓名,如果是PI/教授,還請注明。
原標(biāo)題:《Cancer Cell:甘波誼團隊首次發(fā)現(xiàn)放療會誘導(dǎo)癌細(xì)胞銅死亡,提出破解癌癥放療抵抗新思路》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




