- +1
國產創新藥的突圍之路
創新藥行業,似乎一直與資本市場所追崇的價值投資理念相違背。
創新藥的研發周期十分漫長。從實驗室發現新的分子或化合物開始,經過動物實驗了解其安全性以及毒性反應,了解在動物體內的代謝過程,作用部位,和作用效果,再經過首次人體試驗,經歷I期,II期,III期臨床試驗,證實安全有效及質量可控制之后,才可以獲得藥物監管機構的批準。這其中實驗失敗的風險概率不小,并且經過這個周期大致需要十年時間。
投資創新藥企業,從勝率角度出發更像是風險投資,連巴菲特等投資大佬都很少投資單一公司。然而,近期我國創新藥的投資價值在經歷估值殺跌后,卻漸漸迎來了很大的邊際改善,如今正在國內、香港上市的創新藥企是否即將否極泰來?本文將詳細解析。
估值殺跌后,中國創新藥企越挫越勇
中國創新藥行業,經歷了多次蛻變。
第一階段,是上世紀末到2009年的綠林草莽期。那時,天使投資大多由非專業投資人主導,但在部分有遠見的政府支持下,貝達醫藥、微芯生物等先行者嶄露頭角。
第二階段,是2010年到2014年的破局啟動期。具有前瞻性的海歸們紛紛回國,國內的投資也開始加大力度。在fast follow策略的推動下,百濟神州、君實生物等企業崛起。
第三階段,是2015年至今的風云際會期。藥企們深刻認識到創新是發展的源泉,開始放眼全球,追求國際化。因此,傳奇生物等新勢力脫穎而出。
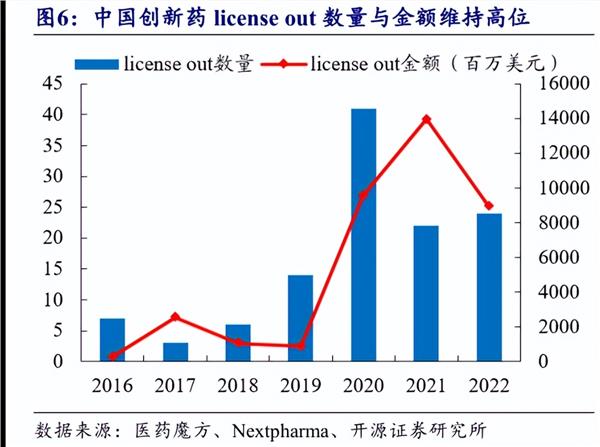
2019-2022 國內創新藥license out 的數量與金額迎來高速增長,藥物類型上趨向多元化。2022 年license out 的數量為24,金額達89.2 億美元,維持高位。
國產創新藥出海突圍不是一帆風順的,2022年中國藥企便突發了“黑天鵝事件”。
2022年2月11日,信達生物發布公告,披露其PD-1藥物出海遭遇挫折。
美國食品藥品監督管理局(FDA)腫瘤藥物咨詢委員會(ODAC)以14:1的投票結果要求信達生物補充額外的臨床試驗,以消除目前產品存在的兩大不足:“臨床試驗缺乏國際多中心臨床研究和頭對頭試驗”。
ODAC提出異議的主要原因在于,信迪利單抗所基于的ORIENT-11三期臨床僅在中國進行,而非國際多中心臨床研究(MRCT),不符合臨床試驗人群的多樣性原則。此外,該臨床試驗以無進展生存期(PFS)為臨床終點,而FDA認為應當以總生存期(OS)為臨床終點,并且應該將已批準的PD-1療法作為對照組進行頭對頭試驗。
公告顯示,根據委員會投票建議,信迪利單抗需要證明在美國人群和美國醫療實踐中的適用性,但提示“ODAC投票意見不具有對FDA決策的約束力”。此前,公司公布的FDA作出決議的目標日期是2022年3月。
與此同時,君實生物、百濟神州、康方生物等國產PD-1企業也已向FDA遞交上市申請。盡管這些企業均基于國際多中心臨床試驗向FDA提出上市申請,但其對照組分別為化療、安慰劑等。在美國對PD-1單抗審批收緊的背景下,缺乏頭對頭實驗正成為出海的阻礙。
在出海重磅產品受挫后,國內創新藥龍頭企業開始大幅殺跌,僅2022年單年,帶頭的信達生物跌幅就超30%,港股18A創新藥企業更是哀鴻遍野,資本市場開始重新審視創新藥這個行業的投資價值。
然而,2023年國產創新藥出海又開始有了轉機。
10月29日,君實生物(01877)宣布,由公司自主研發的抗PD-1單抗藥物特瑞普利單抗(美國商品名:LOQTORZI)的生物制品許可申請(BLA)于近日獲得美國食品藥品監督管理局(FDA)批準,特瑞普利單抗由此成為FDA批準上市的首個中國自主研發和生產的創新生物藥。
據悉,該藥品成為美國首款且唯獲批用于鼻咽癌治療的藥物,也是FDA批準上市的首個中國自主研發和生產的創新生物藥。預計LOQTORZI將于2024年第一季度在美國上市。
除了君實生物以外,和黃醫藥味隆替尼三線結直腸癌、百濟神州替雷利珠單抗食管癌二線適應癥等將有望在2023年底前獲得最終審評結果。
中國創新藥終于在國際市場上揚眉吐氣了一回,但這只是突圍的開始,隨著國產廠商進入國際市場,與全球醫藥龍頭的激烈競爭可能才剛剛開始。
政策規范后,國產創新藥將以實力見真章
談及我國醫藥行業,人們常常將其與國內政策的不確定性相提并論。然而,今年的政策改革如同破曉的曙光,為這一行業帶來了新的希望和機遇。

今年以來監管已出臺多項政策及相關文件,體現了對創新藥行業的支持。例如,NMPA正式頒布《藥物臨床試驗機構監督檢查辦法(試行)》,這一辦法,進一步規范臨床試驗開展地點的監管流程,同時對不規范備案機構的處罰原則進行厘清,做到有章可循,有法可依。
在剛剛落幕的“第十五屆中國醫藥企業家科學家投資家大會”上,國家醫療保障局醫藥價格和招標采購司副司長翁林佳發表了主題演講。
人們對國家藥品價格談判時的靈魂砍價記憶猶新,生物醫藥行業對創新藥定價頗有微詞。從主管官員的上述表述來看,國家醫保局將根據創新藥的不同生命周期,給予不同的價格定位,初期將滿足企業盡快回收研發成本的要求,給予合理的價格回報。這對生物醫藥板塊來說,無疑是個重磅利好。
顯然,國家醫保局已不再單純追求醫保費用的下降,而是注重醫保控費與鼓勵生物醫藥行業發展的平衡。這對于需要大量資金進行研發投入的創新藥企業來說,是一個巨大的利好。這意味著國內醫藥政策已經進入穩定期。
隨著外圍因素的消解,國內創新藥企在迎來普漲后,到了以實力見真章的階段。
根據研發費用排名,港股前十的藥企有:百濟神州、復星醫藥、石藥集團、和黃醫藥、麗珠醫藥、翰森制藥、信達生物、先聲藥業、康方生物。
A股前十名的藥企有:恒瑞醫藥、科倫藥業、君實生物、健康元、神州細胞、百奧泰、浙江醫藥、以嶺藥業、迪哲醫藥。
可以發現,A/H股的前三名藥企在研發方面的投入呈現出顯著的優勢,其投入的資金成倍于其他藥企。這種大規模的研發投入,使得這些企業在售的創新藥品類數量上占據了優勢。然而,這并不意味著中小型創新藥企沒有機會。相反,他們更加專注于小而美的賽道,這種專注和執著可能會帶來意想不到的爆發。
在這些名單中有許多藥企正突破市場預期。
百濟神州以源頭創新研發能力強勁著稱,目前擁有超過60項臨床前項目。自2024年起,公司預計每年將推動10款以上新的分子藥物進入臨床階段。然而,對于像百濟神州這樣規模的制藥公司來說,臨床早期分子的交易已經無法影響公司的大局,除非數量足夠多;對于百濟來說,真正有潛力的分子,公司也有能力將其推進至臨床后期再授權出去。因此,目前在臨床階段的分子成果對公司至關重要。
恒瑞醫藥從國內仿創龍頭企業成功轉型為創新藥龍頭企業,成為少數能在研發規模上與跨國制藥巨頭媲美的中國藥企之一。
恒瑞醫藥持續穩步推進國際化戰略,堅持自主研發與開放合作并重,在內生發展的基礎上加強國際合作。今年7月,卡瑞利珠單抗(艾瑞卡)聯合甲磺酸阿帕替尼片(艾坦)(“雙艾”組合)用于不可切除或轉移性肝細胞癌患者一線治療的生物制品許可申請已獲得美國食品藥品監督管理局(FDA)正式受理;除卡瑞利珠單抗外,創新藥Edralbrutinib片、海曲泊帕均已獲得美國FDA孤兒藥資格認定,有望加快推進臨床試驗及上市注冊進度;多個項目在美國、歐洲、亞太等國家和地區獲得臨床試驗資格。
復星醫藥是少數在重塑自身過程中沒有發生經營顛簸或失速的公司之一,僅用4年時間就平穩實現了創新藥收入突破100億元,在生物藥、細胞療法、mRNA領域處于一線,并擁有最大的海外商業化團隊的大型醫藥集團。
以嶺藥業是極少地正通過科學的臨床試驗和中醫理論相結合使創新中藥走向國際的引領者。
目前公司有 9 個中藥創新藥品種處于臨床階段。近期,治療糖尿病視網膜病變的通絡明目膠囊申報新藥已獲批,產品是公司運用中醫絡病理論指導下,在臨床經驗方基礎上研制的創新中藥。公司對該藥品開展了隨機、雙盲雙模擬、羥苯磺酸鈣膠囊平行對照的多中心臨床試驗。臨床試驗研究結果顯示,治療12 周后,中度非增殖性糖尿病視網膜病變的點片狀出血試驗組優于對照組。我國糖尿病患者群體龐大,糖尿病患者隨著病程的加長,糖網的患病率逐步攀升,發病率非常高。同時公司已擁有針對二型糖尿病的津力達顆粒,預計與新品形成較強的科室協同,通絡明目未來市場空間廣闊。
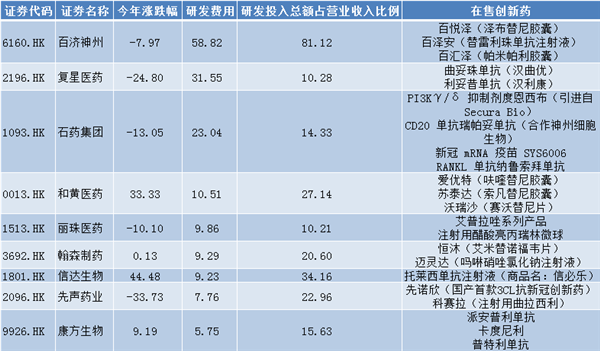
(表1:港股創新藥企研發費用前十名
數據來源:同花順iFind)
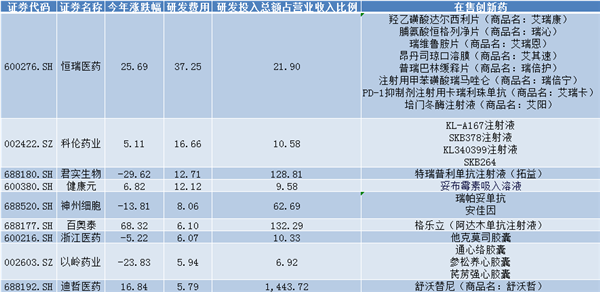
(表2:A股創新藥企研發費用前十名
數據來源:同花順iFind)
總結來看,近年來國內創新藥研發水平不斷提高,新興技術逐漸成熟,政策環境逐步回暖;多款重磅創新藥放量提速,商業化潛力逐步兌現,出海邏輯依然堅挺。隨著美聯儲最后一次加息落地,美債收益率見頂后進入新一輪下降周期,全球流動性重回寬松。在此背景下,創新藥大概率將開啟新一輪波瀾壯闊的長期向上行情。AH股中的優秀中國創新藥企或將開始嶄露頭角,迎來中國創新藥大時代!
本文為澎湃號作者或機構在澎湃新聞上傳并發布,僅代表該作者或機構觀點,不代表澎湃新聞的觀點或立場,澎湃新聞僅提供信息發布平臺。申請澎湃號請用電腦訪問http://renzheng.thepaper.cn。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




