- +1
特稿|重癥肌無力新藥的背后:罕見病治療“鯰魚效應”何來?
2018年1月,一劑Milasen通過腰椎穿刺注入7歲女孩Mila的鞘內,人類醫療迎來里程碑:FDA歷史上首次批準為一個病人設計開發反義核酸藥物、“單一患者”(N-of-1)概念首次成為現實……
盡管Mila最終去世,但這位患有罕見的致死性神經退行性疾病——神經元蠟樣脂褐質沉積癥7(CLN7,巴頓病)中的一種的女孩,一度也曾因為她量身定制的藥物燃起過生的希望。而對很多罕見病患者而言,無藥可治是不得不面對的現實。
國家藥品監督管理局副局長陳時飛在去年的中國罕見病大會上表示,罕見病藥品研發難度大、幅度高、周期長,一直難以滿足患者臨床需求。國內罕見病治療領域主要存在部分罕見病全球無藥可用、部分罕見病藥物,尚未在境內上市、存在超適應癥用藥的現象、部分低價罕見病藥物發生供應短缺等關鍵問題。
不過,近年來,受國內整個生物醫藥產業發展的帶動,以及國家相關政策的陸續出臺,除國外已有而國內患者亟需的用藥引進步伐加快之后,國內關注罕見病藥物的企業也在逐漸增多。
“國家有很多政策上的傾斜,比如出臺了罕見病目錄,對于罕見病的藥物審批也有加快的趨勢,國家逐漸重視罕見病的診療,所以我們覺得這是一個天時、地利、人和的局面。”再鼎醫藥首席商務官兼大中華區總裁梁怡在接受澎湃新聞(www.6773257.com)記者采訪時表示,這促使了公司會更加重視自身免疫性疾病罕見病的投入。
再鼎醫藥總部位于上海,成立于2014年3月。成立3年后的2017年9月,公司在美國納斯達克上市,于2020年9月在香港聯交所二次上市。值得一提的是,再鼎醫藥的創始人、董事長兼首席執行官杜瑩博士是中國生物產業的領軍人物之一。這家已經擁有4款商業化產品的公司,將自身免疫性領域視作“比肩腫瘤”。
就在6月15日,也就是第九個重癥肌無力關愛日到來之際,全球首款FcRn拮抗劑efgartigimod落地博鰲樂城國際醫療旅游先行區(下稱“樂城先行區”),成為我國三十年來重癥肌無力藥物的新突破。2021年1月,再鼎醫藥宣布從argenx獲得在大中華區獨家開發和商業化efgartigimod的權利,argenx獲得總計1.75億美元的合作付款,同時將按比例獲得efgartigimod在大中華區的年凈銷售額分成。

全球首款FcRn拮抗劑efgartigimod落地博鰲樂城國際醫療旅游先行區。
2021年12月,efgartigimod在美國獲批上市。efgartigimod的獲批是基于全球3期臨床研究ADAPT的結果,該結果已發表于2021年7月出版的《柳葉刀·神經病學》(The Lancet Neurology)。ADAPT研究是一項26周的隨機、雙盲、安慰劑對照的全球性、多中心臨床研究,旨在評估efgartigimod在gMG患者中的安全性和療效,北美、歐洲和日本共有167名成人gMG患者入組該研究。
復旦大學附屬華山醫院神經內科副主任、華山罕見病中心工作小組主任趙重波教授在接受澎湃新聞(www.6773257.com)記者采訪時表示,像efgartigimod這樣高級別循證醫學的新藥進入中國市場以后,“它會產生‘鯰魚效應’,帶動國內的研究機構、藥企更加關注重癥肌無力這一疾病,進一步研發治療這個疾病更加安全有效的藥物。”
中國重癥肌無力患者至少20萬,影響青壯年
眼皮下垂、看東西有重影、講話吐字不清楚、喝水會嗆、嚼東西費力、抬頭無力、手腳無力,一個青壯年甚至做不到穿衣和刷牙,蹲下去后可能很難再獨自站起來……,嚴重者甚至呼吸衰竭命懸一線。
這類患者在中國保守估計有20萬,所患疾病為全球近7000種罕見病中的一種,即重癥肌無力(MG)。
趙重波介紹道,從發病機制上來說,重癥肌無力是一種自身免疫性疾病。該疾病是由自身抗體介導的獲得性神經-肌肉接頭(NMJ)傳遞障礙的自身免疫性疾病,其中,乙酰膽堿受體(AChR)抗體是最常見的致病性抗體。“這一抗體和肌肉細胞表面的乙酰膽堿受體結合之后,會阻斷受體和激活補體,從而影響肌肉細胞的功能,造成肌肉細胞無法很好地收縮。”

復旦大學附屬華山醫院神經內科副主任、華山罕見病中心工作小組主任趙重波教授。
在臨床表現上,患者全身骨骼肌均可受累,表現為波動性無力和易疲勞性,癥狀呈“晨輕暮重”,活動后加重、休息后可減輕。而眼外肌最易受累,表現為對稱或非對稱性上瞼下垂和/或雙眼復視,是重癥肌無力最常見的首發癥狀,見于80%以上的患者。
趙重波用四個字來形象地描述該疾病,“隨波逐流”。“隨”就是指受累的是隨意運動的肌肉,也就是骨骼肌;“波”是指癥狀的波動性;“逐”是它影響的肌肉會逐漸從局部擴展到全身;“流”就是輪流,也就是肌肉的無力可以輪流出現,比如某位病人一段時期內是左眼瞼掉下來,一段時間后則換成左眼瞼掉下來,也被稱為交替性的眼瞼下垂。
由中國免疫學會神經免疫分會撰寫的《中國重癥肌無力診斷和治療指南(2020版) 》顯示,重癥肌無力全球患病率為(150-250)/百萬,預估年發病率為(4-10)/百萬。而我國重癥肌無力發病率約為0.68/10萬 ,女性發病率略高;住 院死亡率為14.69‰ ,主要死亡原因包括呼吸衰竭、肺部感染等。
從發病年齡段來看,6個月以上的幼兒即有一定的概率被這一疾病擊中。“當免疫系統基本發育以后,作為一種自身免疫性疾病,重癥肌無力就會影響到病人的功能。”趙重波表示,盡管各個年齡階段均可發病,但30歲和50歲左右呈現“發病雙峰”。 此外,最新的流行病學調查還顯示,我國70歲左右還存在一個發病“高峰”。
作為一種慢性疾病,重癥肌無力在臨床是有治療方案,但至今很難被治愈。
治療方案之一是對癥治療,使用膽堿酯酶抑制劑溴吡斯的明,去增加神經肌肉接頭傳遞的乙酰膽堿的數量,在癥狀學上改善病人的病情。溴吡斯的明目前也是最常用的,是治療所有類型重癥肌無力的一線藥物,可緩解、改善部分重癥肌無力患者的臨床癥狀。不過,趙重波介紹,“它不能治本,只能治標。”
談到治標,還是要著眼于免疫系統的調節。趙重波介紹的第一塊治療方案即是免疫抑制治療。目前,免疫治療常用的藥物是糖皮質激素,“這是目前各種指南和共識推薦的一線的免疫治療。”常用的還包括硫唑嘌呤、他克莫司、環孢素、嗎替麥考酚脂、環磷酰胺等其他口服非激素類免疫抑制劑。此外,對于難治性患者,最近臨床上使用較多的還有抗CD20單克隆抗體。
第三塊是挽救治療,即短期之內改善病人的病情。趙重波介紹,這類治療以清除致病性抗體為主要目標,包括血漿置換、靜脈注射免疫球蛋白、免疫吸附等。“這些治療起效比較快,但是缺點是維持療效的時間相對比較短,而且存在安全性和可及性的問題。”這里的可及性主要是指,有的醫院醫療條件不允許開展,此外病人經濟上難以承受。
第四塊治療方案則主要為胸腺切除。值得注意的是,80%-90%的重癥肌無力患者伴有胸腺異常,即胸腺增或胸腺瘤。趙重波表示,伴有胸腺瘤的病人需盡早切除胸腺瘤,而伴隨有胸腺增生的病人則要看重癥肌無力病情控制情況,“如果控制有難度,對于乙酰膽堿受體抗體陽性的全身型患者來說,現有高級別的循證醫學證據也表明,切除胸腺對于這類病人遠期的病情控制以及合并減少激素使用方面,都有非常大的幫助。”
趙重波總結道,目前醫生有比較多的“武器”幫助重癥肌無力病人控制病情,讓其盡量恢復到接近正常的工作或者生活狀態。
全球首款FcRn拮抗劑,落地樂城先行區
然而,病情控制較好,卻并不意味著重癥肌無力患者生活質量的提高。這近乎是患者群中一個普遍的悖論。
趙重波談到,從日常生活量表的問卷調查來看,雖然病人的肌力出現了明顯的改善,但是生活質量并沒有出現相應明顯的改善。“很大一部分原因是患者長期使用免疫治療藥物的副作用,包括糖皮質激素和其他免疫抑制劑。”
對于慢性病患者來說,激素類藥物長期使用之后產生的體形變胖、骨質疏松、高血壓、糖尿病、痤瘡、皮膚多毛,以及非激素類免疫抑制劑長期使用后出現白細胞減少、肝功能損害等多種副作用,這些都令重癥肌無力患者難以接受,從而對現有治療方案“非常不滿意”。
趙重波總結道,盡管重癥肌無力是一個可治的疾病,也獲得了不錯的控制結果,然而也存在著多個痛點。
第一,依然有15%-20%病人對現有的治療反應不好;第二,在全身型重癥肌無力患者中,有20%的人可能會出現重癥肌無力危象,這一危象在全球的死亡率波動在3.5%-11%,醫療條件差的地方死亡率更高;第三,目前用來治療重癥肌無力的藥物,包括糖皮質激素、免疫抑制劑,都是有一定的副作用,快速起效的挽救治療如血漿置換,可能會因去除其他大分子物質而對固有免疫系統產生影響等,免疫球蛋白雖然較安全,但是價格比較貴,經濟上很難承受;第四,該疾病累及很大一部分青壯年,青壯年是社會發展的主力軍,會對生產力產生較大的影響。
趙重波將2016年視為重癥肌無力治療的分水嶺。“2016年MGTX研究結果發布以前,基本上都是以低級別循證醫學證據,再加上專家的觀點為主,因為它缺乏高級別循證醫學的RCT(隨機對照研究)支持。”
原因之一在于,針對重癥肌無力疾病開展RCT研究天然有一定的難度,“這個難度在于疾病本身,它本身有波動起伏,會抵消掉對于一個活性藥物的觀察。另外研究的設計以前可能缺乏經驗、有缺陷,所以得不出陽性的結果。”
2016年以后,隨著全球幾個重磅的高質量的RCT研究問世,重癥肌無力循證醫學的治療被改寫。“針對補體C5或者針對FcRn的拮抗劑,這兩個生物靶向藥物治療重癥肌無力有效,而且獲得了美國FDA適應證的批準。”
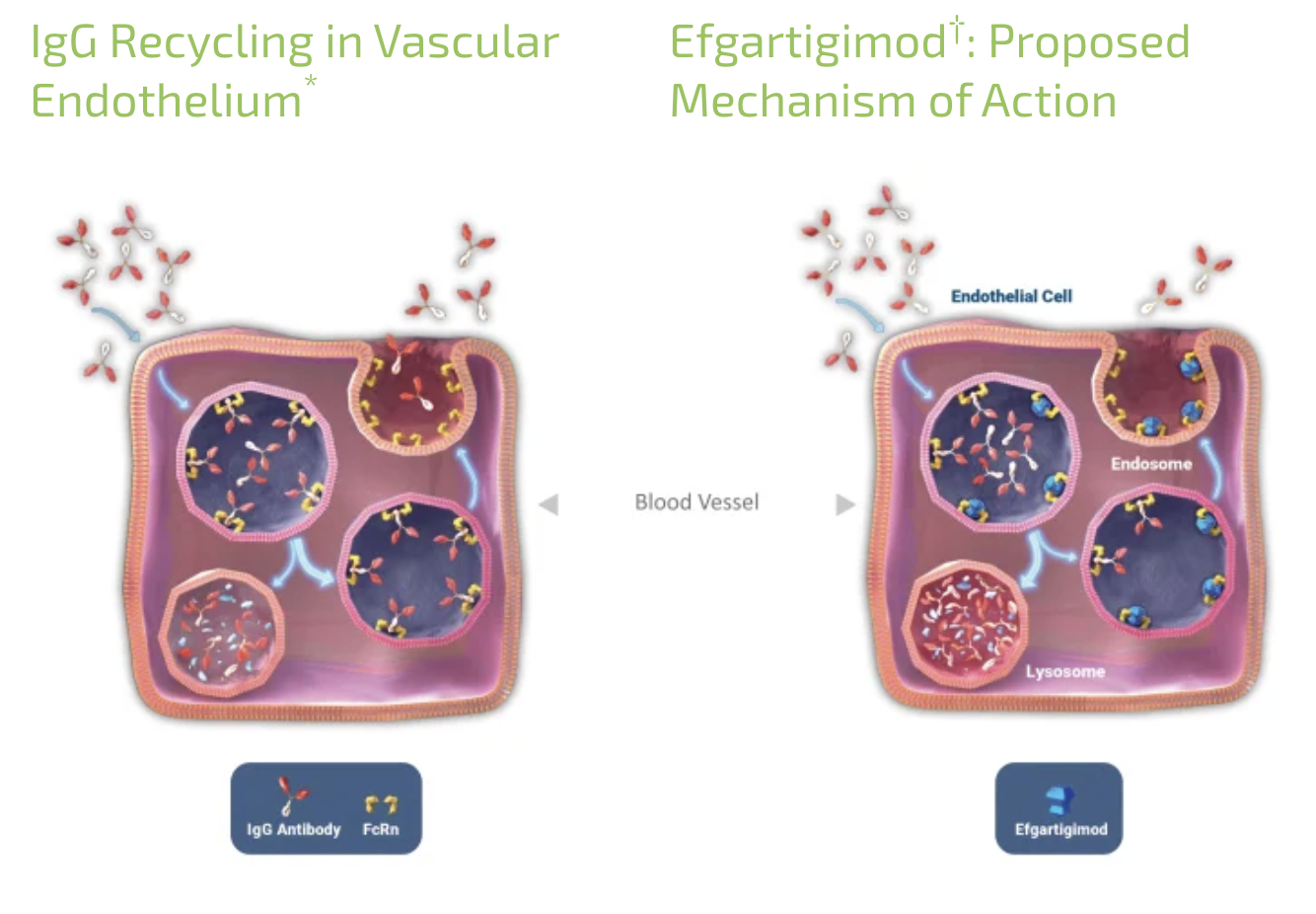
以efgartigimod為例,該藥物是一款靶向新生兒Fc受體(FcRn)的人IgG1抗體Fc片段。FcRn已被證明可以結合IgG并使其免于被溶酶體降解,與IgM或IgA(半衰期大約5天)相比,IgG的半衰期被延長至大約21天,FcRn不參與IgA和IgM的再循環。作為一種經過生物工程改構的IgG抗體 Fc片段,efgartigimod與FcRn有較高的親和力,能與IgG競爭結合FcRn并減少總體IgG再循環,進而降低IgG的總體水平,其中也包括重癥肌無力中存在的致病性AChR抗體。
臨床前和臨床研究已證明,efgartigimod可快速、持續地降低IgG水平,而不影響IgM、IgA或白蛋白。

發表于《柳葉刀·神經病學》上的ADAPT研究旨在實現個體化治療方式,包括初始治療周期和基于臨床評估的后續治療周期,其達到了主要研究終點,表明與安慰劑相比,efgartigimod治療后,有明顯更多的乙酰膽堿受體抗體陽性的gMG患者是重癥肌無力日常生活(MG-ADL)評分應答者(68% 對比30%;p < 0.0001)。應答者定義為在第一個治療周期內MG-ADL 評分至少改善2分且持續時間至少4周。此外,efgartigimod治療后患者的定量重癥肌無力評分(QMG)的應答率也明顯高于安慰劑。應答者定義為第一個治療周期內QMG評分至少改善3分且持續時間至少4周。該臨床研究也證實了efgartigimod在gMG中具有良好的安全性。最常見的不良反應是呼吸道感染、頭痛和尿路感染。
2021年12月,efgartigimod在美國獲批上市,成為全球首個且目前唯一獲批的FcRn拮抗劑,也是首個獲批的通過內源性減少致病性抗體而專門治療全身型重癥肌無力的療法。
趙重波對澎湃新聞記者表示,efgartigimod的優勢主要是體現在起效速度非常快,用藥一周可能有部分患者就會有主觀上病情的改善,用藥兩周病情明顯改善,醫生可以非常清晰地觀察到患者病情的明顯改善。此外,療效維持時間相對較長,“實際上慢性病停藥以后絕大多數病人的病情會反彈,但是efgartigimod如果用了有效,停藥以后療效能繼續維持數周,甚至停藥12周時依然有33%的患者病情能夠維持很好的控制。”
趙重波補充道,由于該藥物的使用,使得針對重癥肌無力患者此前一直討論的精準治療有了實現的可能。“病人現在有癥狀,工作生活都受影響,那么就開始給藥,每周給藥一次,四次后一般病情控制得非常好,就停藥,停了以后患者就可以繼續工作生活。他可能有30%的概率在三個月以上病情一直非常穩定,當然也有70%的概率在三個月之內病情又反復了,那再過來繼續給第二個循環的治療。”
海南省人民醫院神經內科主任黃仕雄教授則表示,“efgartigimod這款全球首創新藥引入樂城,已經成為我國三十年來重癥肌無力藥物的新突破。作為一種罕見病,重癥肌無力的治療涉及到多個學科,為了患者能夠順利且安全地接受新藥治療,我們已經成立了包括神經內科、急診科、ICU等在內的專門的醫療小組,并聯合國內神經內科領域知名專家建立了專門的遠程多學科會診機制,最大程度保障重癥肌無力患者就醫質量。”
海南省藥監局局長朱寧指出,“得益于國務院賦予樂城的特許藥械政策,省藥監局批準由再鼎醫藥引進的,治療重癥肌無力的國際創新藥物在樂城使用,為國內重癥肌無力患者帶來了新希望。”她提到,特許藥械政策實施四年來,海南省藥監局不斷擴大特許藥械政策的適用性和惠及面,持續推動特許藥械審批提速取得新成效。
值得一提的是,早在2020年4月,樂城先行區就建立了罕見病中心,整合島內島外專家資源,聯合公立醫院等持續為罕見病患者提供醫療服務,并進一步探索解決罕見病群體在診斷、治療和用藥可及性等方面的難題,推動更多國際創新藥械進入中國。據介紹,截至目前,樂城先行區進口特許藥械品種已經突破220例,其中即包含用于治療罕見病的各類新藥。
此外,梁怡還對澎湃新聞記者表示,efgartigimod是“Product-in-a-Pipeline”,“也就是說這是一款單一產品具有多適應證潛力的重磅新藥,對于多種嚴重的自身免疫性疾病都有可能成為新的治療手段。”
梁怡表示,efgartigimod在重癥肌無力的全球關鍵性三期臨床研究ADAPT研究已經完成了,它在國內我們已經進入即將申請注冊這樣一個階段。“除了重癥肌無力,efgartigimod也正在CIDP(慢性炎性脫髓鞘性多發性神經根神經病)、ITP(原發免疫性血小板減少癥)、PV(天皰瘡)等多個自身免疫性疾病中開展全球臨床研究。”
疾病治療格局將有何改變?“三個層次”
值得我們關注的是,對于罕見病而言,一款療效較好的治療藥物的問世,意義不僅僅在于其本身所帶來的獲益。
一個國內熟知的例子就是SMA(脊髓性肌萎縮癥)。SMA是一種由于運動神經元存活基因1 (SMN1)突變所導致的常染色體隱性遺傳病,因脊髓前角及延髓運動神經元變性,導致近端肢體和軀干進行性、對稱性肌無力和肌萎縮,位居2歲以下兒童致死性遺傳病的首位。
SMA患者的希望始于2016年。浙江大學醫學院附屬兒童醫院神經內科主任醫師、脊髓性肌萎縮癥多科學診療團隊(SMA-MDT)組長,同時也是浙江省SMA診療專家組組長的毛姍姍此前則接受澎湃新聞(www.6773257.com)記者采訪時提到,致病基因被發現20年后,SMA的第一個疾病修正治療(DMT)藥物獲批。所謂DMT,是指通過影響疾病的病理生理過程,對該疾病的病程產生有益結局的治療或干預手段。當年12月,諾西那生鈉注射液在美國獲批。
中國SMA患者“藥物治療時代”的元年是2019年。當年2月,諾西那生鈉注射液正式獲得國家藥監局批準,成為中國首個治療SMA的藥物。截至目前,國內共有兩種藥物批準用于治療SMA。除諾西那生鈉注射液外,2021年的6月,國家藥監局通過優先審評審批程序批準羅氏制藥公司申報的1類創新藥利司撲蘭口服溶液用散(中文商品名:艾滿欣?,英文商品名:Evrysdi?)上市,用于治療2月齡及以上患者的SMA。目前,利司撲蘭在美國已獲批用于治療所有年齡段的兒童和成人SMA患者。
國家醫保局談判代表張勁妮等人去年一場長達90分鐘的“靈魂談判”則將曾經的“天價藥”惠及更多SMA患者。
在毛姍姍看來,有藥可治是讓SMA關注度大幅提升的一個重要因素,“諾西那生鈉進入醫保以后,藥一下子便宜了很多,引發了全國的關注,這一信息通過媒介一下子就遍及了全社會。以前不被認識,主要還因為沒有有效的治療方案,很多基層的醫生都不認識這個疾病。”
今年以來的短短5個月內,毛姍姍團隊診治管理的接受諾西那生鈉治療的SMA患者是“井噴狀”的,此前未經治療的患者大量涌現出來。更為重要的是,隨著更多SMA患者嘗試治療,這些患者整體生存質量的提高將會被日益重視。
efgartigimod對國內重癥肌無力治療的影響也將產生多方面影響。在趙重波看來,這款新藥對疾病治療的格局將帶來三方面的改變。
第一,從疾病本身來講,毫無疑問是給醫生提供了一個新的治療“武器”,能夠幫助對其它治療效果不好的病人,此外也能幫助有一定經濟條件使用這種藥物、而不想使用激素或者其它潛在副作用免疫抑制劑的部分患者提供了新的治療手段。“我們的‘治療武器庫’是增加了。”
第二,帶有高級別循證醫學證據的新藥進入中國市場以后,會產生“鯰魚效應”。“它會帶動國內的研究機構、藥企更加關注這個疾病,進一步研發重癥肌無力的創新治療藥物。”趙重波強調,一款新藥進來以后帶動的不僅僅是現有的治療格局改變,而且還對未來該疾病更多新藥的研發注入了活力,“因為讓大家看到了希望,所以說這個價值可能是更大的。”
第三,新的治療藥物出現以后,藥企的這種成功也會對疾病的學術方面有所推動。趙重波舉例談到,PUBMED數據庫中發表的關于重癥肌無力的文獻可以看到,在2017年REGAIN研究(注:FDA批準用于全身型重癥肌無力治療的補體抑制劑Eculizumab的在3期臨床試驗)發表之前,每年發表的研究文章數目是一個數量級,但是REGAIN研究以及后來efgartigimod的ADAPT研究以后,每年的重癥肌無力研究文章比原來明顯多了很多。“這就是說,新藥成功以后會帶動這個疾病領域的研究,也就會帶動更加創新的藥物的研發,從而會給這個疾病的治療帶來更多的‘武器’。”
不過,鑒于目前efgartigimod僅在樂城先行區獲批使用,同時該藥物為針劑,有需求的重癥肌無力患者仍需自行前往進行相關的治療。對此趙重波強調,“沒有在中國上市的全球新藥在樂城先行區落地使用,這本身就是探索性的政策,先走第一步,慢慢地積累經驗。”





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2024 上海東方報業有限公司




