- +1
阿爾茨海默病新藥大潰敗,美國FDA是否會(huì)改變審查藥物的方式
約一年前,美國食品和藥物管理局(FDA)加速審批了治療阿爾茨海默病的新型藥物aducanumab,藥品上市后不斷引發(fā)爭議。據(jù)《自然》雜志(www.nature.com)報(bào)道,就在近日,美國聯(lián)邦立法者試圖修改導(dǎo)致該藥物獲得批準(zhǔn)的這一流程。
負(fù)責(zé)監(jiān)督藥物安全和生物醫(yī)學(xué)研究的美國眾議院能源和商業(yè)委員會(huì)(House Committee on Energy and Commerce)上周宣布,它希望賦予FDA更大的權(quán)力,即如果一家制藥公司未能在合理的時(shí)間內(nèi)完成后續(xù)研究,F(xiàn)DA能夠撤消通過加速審批上市的藥物。
這項(xiàng)擬定中的條款,將作為FDA資金重新授權(quán)法案(FDA funding reauthorization bill)的一部分,或有望在9月前通過。

美國食品和藥物管理局(FDA)局長羅伯特?卡利夫(Robert Califf)承諾,將對(duì)藥品加速審批程序進(jìn)行改革。
2021年6月7日,F(xiàn)DA宣布加速審批單抗藥物aducanumab(商品名Aduhelm)上市,用于治療阿爾茨海默病源性輕度認(rèn)知障礙(MCI)及輕度阿爾茨海默病(AD)。aducanumab由總部位于馬薩諸塞州劍橋的生物科技公司渤健(Biogen)開發(fā),作為眾多基于β-淀粉樣蛋白假說研發(fā)的AD治療藥物之一,Aducanumab經(jīng)臨床研究顯示可以選擇性結(jié)合β-淀粉樣蛋白,清除阿爾茨海默病患者大腦中的β-淀粉樣蛋白堆積。
然而,沒有明顯證據(jù)顯示該藥物能夠減緩阿爾茨海默病患者臨床認(rèn)知衰退,盡管當(dāng)時(shí)一個(gè)獨(dú)立專家小組幾乎全票反對(duì)批準(zhǔn)該藥物,F(xiàn)DA還是加快了對(duì)該藥物的審批。FDA顧問小組三名成員隨后辭職以抗議這一決定,該批準(zhǔn)也隨后成為美國聯(lián)邦監(jiān)管機(jī)構(gòu)多項(xiàng)調(diào)查的對(duì)象。
Aducanuma上市后的銷售情況同樣暗淡無光。據(jù)渤健公司2021年財(cái)報(bào),藥物自2021年6月上市以來銷售額僅300萬美元,2022年第一季度顯示,Aducanuma的銷售額為280萬美元。
Aducanumab并不是這種藥物批準(zhǔn)途徑受到抨擊的唯一原因。自啟動(dòng)以來,F(xiàn)DA的藥物加速審批程序已使得279種藥物進(jìn)入市場,其中有近三分之二發(fā)生在過去十年之間。該程序變得越發(fā)普遍,這或許意味著其初衷的轉(zhuǎn)變,美國華盛頓特區(qū)非營利組織國家衛(wèi)生研究中心(National Center for Health Research)主席戴安娜·祖克曼(Diana Zuckerman)說。
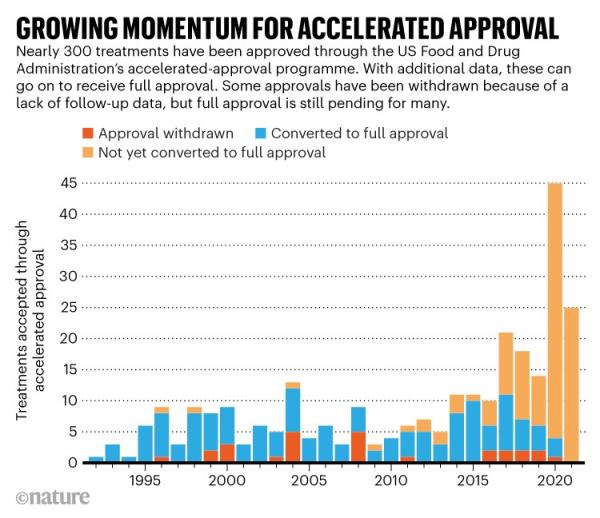
圖表顯示了自1992年以來,美國經(jīng)加速審批上市的藥物增長趨勢。
“加速審批最初是針對(duì)少數(shù)藥物的特殊程序,現(xiàn)在大多數(shù)抗癌藥物正在經(jīng)歷加速或是其它的一些加急途徑。”她說。
此外,制藥公司遲遲未能完成他們?cè)谂鷾?zhǔn)程序中所承諾的后續(xù)研究,而FDA在強(qiáng)制要求他們提供數(shù)據(jù)方面的權(quán)力有限。此次立法提案——在眾議院和參議院通過的過程中仍可能發(fā)生重大變化——或許能夠賦予FDA更大的權(quán)力。
在今年2月被任命前幾天,F(xiàn)DA局長羅伯特?卡利夫(Robert Califf)承諾,將把改革加速審批作為該機(jī)構(gòu)的優(yōu)先事項(xiàng)。接受《自然》采訪的研究人員也認(rèn)為,這套程序確實(shí)需要改革以保護(hù)其完整性,而擬議中的立法條例是一個(gè)良好的開端。但他們也建議加強(qiáng)機(jī)構(gòu)監(jiān)管,同時(shí)進(jìn)行其它改革,以進(jìn)一步防止制藥公司濫用這條藥物進(jìn)入市場的途徑。
“制藥公司并沒有按照預(yù)期使用這條加速審批的路徑,相反,太多的制藥公司寧可想方設(shè)法地尋找程序的漏洞,進(jìn)而利用漏洞。”華盛頓特區(qū)的非營利性組織“患者負(fù)擔(dān)得起的藥物”(Patients for Affordable drug)的主席大衛(wèi)·米切爾(David Mitchell)說,他是FDA審查抗癌藥物的獨(dú)立委員會(huì)的消費(fèi)者代表。
有必要那么快嗎?
FDA在1992年創(chuàng)建了藥物加速審批通道,當(dāng)時(shí)主要是為了應(yīng)對(duì)艾滋病危機(jī),使迫切需要的藥物立即進(jìn)入市場。在這一途徑下,待審批藥物療效的證明,往往依賴于替代終點(diǎn)(surrogate endpoints),而不是具有臨床意義的終點(diǎn)(如患者存活或癥狀減輕)。替代終點(diǎn)可能比傳統(tǒng)的臨床試驗(yàn)終點(diǎn)更快或更容易跟蹤,例如,腫瘤收縮是癌癥藥物臨床試驗(yàn)中常用的替代指標(biāo),但這一指標(biāo)不一定與患者的直接收益相關(guān)聯(lián)。
格雷戈.岡薩維斯(Gregg Gonsalves)是美國康涅狄格州耶魯大學(xué)的流行病學(xué)家和全球健康專家,他是當(dāng)時(shí)說服FDA采用這一程序的小組成員之一。他表示:“我們推動(dòng)這條加速審批的途徑被采用,是因?yàn)橛腥苏谒廊ィ彼f,“我本人就被檢測出艾滋病毒陽性,我感到很絕望,需要獲得希望。”
這條途徑建立后,市場中免疫藥物和抗癌藥物的數(shù)量顯著增加。其中一些藥物每年需要患者花費(fèi)數(shù)十萬美元,而在許多情況下,顯示它們臨床效用的數(shù)據(jù)依然有限。岡薩維斯認(rèn)為,該程序被制藥行業(yè)采用,以加快審批速度。相比于通過標(biāo)準(zhǔn)途徑,癌癥治療藥物通過這一加速途徑獲得批準(zhǔn),能夠平均提前三年進(jìn)入市場。
美國馬里蘭州約翰霍普金斯大學(xué)彭博公共衛(wèi)生學(xué)院(Johns Hopkins Bloomberg School of Public Health)的內(nèi)科專家和流行病學(xué)家卡勒布.亞歷山大(Caleb Alexander)說,這一路徑的問題之一,在于制藥公司沒有遵守他們的協(xié)議,及時(shí)對(duì)藥物進(jìn)行上市后的研究,充分證實(shí)藥物的益處。一些研究人員質(zhì)疑,制藥公司是否有足夠的時(shí)間來產(chǎn)出這些數(shù)據(jù)。2021年的一項(xiàng)分析發(fā)現(xiàn),在1992年至2016年期間獲得加速審批的藥物中,有13%到藥物沒有在五年內(nèi)轉(zhuǎn)化為全面批準(zhǔn)——在沒有轉(zhuǎn)化所需數(shù)據(jù)的情況下,它們?cè)谑袌錾洗嬖诘钠骄鶗r(shí)間長達(dá)9.5年。
在aducanumab的案例中,F(xiàn)DA允許渤健公司用9年時(shí)間完成aducanumab的確證試驗(yàn),此后,渤健公司表示將在4年內(nèi)完成試驗(yàn)。該公司發(fā)言人表示,試驗(yàn)數(shù)據(jù)(尚未公布,也未經(jīng)過同行評(píng)審)顯示,一些服用該藥的患者的臨床認(rèn)知衰退有所減緩。
在經(jīng)過快速審批程序上市后,阿爾茨海默癥藥物aducanumab的后續(xù)臨床試驗(yàn)仍在持續(xù)。
罕見病公司聯(lián)盟(Rare Disease Company Coalition)的一位發(fā)言人說,藥品上市后的試驗(yàn)可能需要很長時(shí)間,尤其是對(duì)于進(jìn)展緩慢的疾病,如神經(jīng)退行性疾病。罕見病公司聯(lián)盟是華盛頓特區(qū)一個(gè)代表21家制藥公司的組織。此外,制藥公司招募參與者也很困難,因?yàn)槿藗兏敢夥媒?jīng)過全面批準(zhǔn)的藥物,而不愿意冒服用安慰劑的風(fēng)險(xiǎn)。
FDA對(duì)藥品的后續(xù)監(jiān)管能力也顯得頗為有限。祖克曼說,F(xiàn)DA并不能堅(jiān)決要求一家公司停止銷售尚未獲得完全批準(zhǔn)的藥物,而只能請(qǐng)求該公司自愿將其撤出市場。“一旦一種產(chǎn)品獲得批準(zhǔn),F(xiàn)DA就失去了巨大的影響力,”亞歷山大說。
例如,2011年,F(xiàn)DA撤銷了對(duì)用于治療乳腺癌的抗體藥物貝伐珠單抗(bevacizumab)的加速審批,理由是缺乏臨床效益。這導(dǎo)致了公眾的強(qiáng)烈反對(duì),乳腺癌患者給予了情緒化的證詞,希望能夠維持藥物的批準(zhǔn)。位于康涅狄格州丹伯里的非營利組織美國罕見病協(xié)會(huì)(National Organization For Rare Disorders)在2021年的一份報(bào)告中指出,對(duì)許多人來說,加速審批程序提供了“寶貴的希望”。不過,患有多發(fā)性骨髓瘤的米切爾(Mitchell)提出了異議,他說:“FDA的工作不是給我希望。讓我活下去的不是希望,而是安全有效的藥物。”
FDA發(fā)言人杰里米?卡恩(Jeremy Kahn)在一封電子郵件中肯定地宣稱, FDA致力于確保加速審批程序的完整性,他表示,對(duì)于那些缺乏嚴(yán)重疾病治療方案選擇的人而言,他們更愿意接受新治療方法在臨床效益的“一些不確定性”。他還補(bǔ)充稱,絕大多數(shù)加速批準(zhǔn)藥物的臨床效益已經(jīng)得到驗(yàn)證。
改變法規(guī),還會(huì)有同樣的問題嗎?
FDA的藥物加速批準(zhǔn)程序?yàn)槠渌鼑覙淞⒘税駱印5珰W盟和日本賦予了藥物監(jiān)管機(jī)構(gòu)更多的權(quán)力——監(jiān)管機(jī)構(gòu)可以要求制藥公司在規(guī)定的時(shí)間內(nèi)提交驗(yàn)證性試驗(yàn)的數(shù)據(jù),如果公司不這樣做,藥品的批準(zhǔn)會(huì)被撤回。
擬議中的法規(guī)變化將對(duì)FDA產(chǎn)生怎樣的效果,目前不得而知。這些條款會(huì)讓FDA更容易撤銷批準(zhǔn),但也可能延長撤銷批準(zhǔn)的官僚流程。祖克曼說,這會(huì)削弱條款的效力。她更傾向于堅(jiān)持早前的提議,即一旦確認(rèn)性試驗(yàn)過期一年,批準(zhǔn)就會(huì)自動(dòng)撤銷。
祖克曼還建議FDA委員會(huì)辦公室創(chuàng)建一個(gè)獨(dú)立的咨詢團(tuán)隊(duì),以審查顧問小組所反對(duì)的批準(zhǔn)案例——就像aducanumab的情況一樣。她說:“顧問小組的絕大多數(shù)投票都是建議批準(zhǔn),所以當(dāng)他們不建議批準(zhǔn)時(shí),通常有一個(gè)非常好的理由。”
亞歷山大建議使用醫(yī)療保險(xiǎn)作為杠桿。例如,位于巴爾的摩的美國醫(yī)療保險(xiǎn)和醫(yī)療補(bǔ)助服務(wù)中心(CMS)將決定對(duì)哪些藥物提供資金。今年早些時(shí)候,由于擔(dān)心aducanumab的療效,CMS表示,它將只為參加藥物臨床試驗(yàn)的人支付每年28800美元的藥物費(fèi)用。
這一決定幾乎是首開先河,亞歷山大認(rèn)為,對(duì)于其它尚未獲得完全批準(zhǔn)的加速審批藥物而言,CMS也應(yīng)該考慮降低其報(bào)銷率。他說,這樣的舉動(dòng)可能會(huì)“點(diǎn)燃制藥公司的怒火”,以促使其完成試驗(yàn)。“在我們不知道藥物完整的安全性和有效性時(shí),納稅人為什么要為藥物全價(jià)埋單?”他問。
但米切爾擔(dān)心,削減報(bào)銷將使制藥公司失去制造潛在救命藥物的動(dòng)力。在骨髓瘤確診后,他認(rèn)為是三種加速審批的藥物讓他活了下來。
米切爾還認(rèn)為,在加速審批的宏大計(jì)劃中,aducanumab的失敗只是一個(gè)“小插曲”,但他表示,這讓人們更加關(guān)注某些藥物需要進(jìn)行驗(yàn)證性試驗(yàn)。改革并不簡單。一旦一種藥物進(jìn)入市場,米切爾說,“制藥公司并不急于找到一個(gè)理由讓它停產(chǎn)”。
盡管如此,許多研究人員和藥物安全支持者仍然渴望看到變化。祖克曼說:“我們開始試圖修正一個(gè)偏離了初心的問題,看看吧,我們已經(jīng)在這個(gè)方向上走了多遠(yuǎn)。”





- 澎湃新聞微博
- 澎湃新聞公眾號(hào)

- 澎湃新聞抖音號(hào)
- IP SHANGHAI
- SIXTH TONE
- 報(bào)料熱線: 021-962866
- 報(bào)料郵箱: news@thepaper.cn
滬公網(wǎng)安備31010602000299號(hào)
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2024 上海東方報(bào)業(yè)有限公司



