- +1
專訪許錦波:預測蛋白質結構二十余載,這條路如何從冷清到熱鬧
DNA儲存著我們的遺傳信息,然而在細胞中真正執行功能的是蛋白質。每個蛋白質的氨基酸鏈扭曲、折疊、纏繞成復雜的結構,“看清”它們的結構對理解其功能至關重要。但想要破解這種結構通常需要花很長的時間,有些甚至難以完成。
“用機器學習去研究蛋白質結構預測,在這個領域屬于少數派。一直到2016年,甚至到2018年,這個領域大部分人都還在試圖用能量優化,而不是機器學習或者深度學習去研究這個問題。”美國芝加哥豐田計算技術研究所教授、北京大學客座教授許錦波在接受澎湃新聞(www.6773257.com)記者專訪時如是表示。
許錦波被業界譽為“AI預測蛋白質結構全球第一人”。早在2016年,他開發的RaptorX-Contact方法,首次證明了深度學習方法預測蛋白質結構的可行性,讓始終在“門口”徘徊的蛋白質結構預測終于邁出實質性的一步,也自此掀起了AI蛋白質結構預測的熱潮。

美國芝加哥豐田計算技術研究所教授、北京大學客座教授許錦波。
現年48歲的許錦波從小就是一名不折不扣的“學霸”。1990,16歲的許錦波在全國高中數學聯賽中獲江西賽區第一名,這也是當時江西臨川縣首次獲得該類獎項殊榮。1991年,因為在數學競賽中的優異成績,他從臨川一中被保送至中國科學技術大學計算機系,1999年獲得中國科學院計算所碩士學位。2003年,許錦波獲加拿大滑鐵盧大學博士學位,之后任該校研究助理教授、麻省理工學院博士后研究員。
2001年,尚在攻讀博士學位的許錦波開始接觸計算生物學,彼時的導師提議,“有一個很難的問題,就是研究蛋白質折疊,想不想做?”在此后的二十余年時間里,許錦波研究的重要課題之一就是開發和優化軟件,去無限縮小蛋白質結構預測結果和真實構型之間的差距。
近日,在未來論壇主辦的2022《理解未來》科學講座01期“AI+蛋白質結構和功能預測”上,許錦波也首先談到,其實蛋白質結構預測這個問題已經研究了幾十年,過去這個領域一直比較冷清,特別是在2006年到2016年這10年間,“當時大家都覺得這個問題是沒辦法做出來的,所以很多人都離開這個領域去做其他的問題了。”
這樣的冷清已經是過去式。在最近的幾年時間里,這一領域陸續獲得突破性的進展。2020 年,人工智能預測蛋白質結構也被國際頂級學術期刊《科學》雜志評為十大科學突破之一。“現在人工智能預測蛋白質結構受到的關注,遠遠超過了過去幾十年來的關注。”許錦波表示。
然而,在冷清的路上走慣了的許錦波,對眼下的熱鬧并沒有表現出太多的興奮。談及這兩年陸續成立的人工智能應用于生命科學領域的公司,他坦言,“我對產業的了解不是很多,也就最近幾個月開始接觸一些產業界的認識和做投資的人。”當然,許錦波認為,對于“AI For science”的產業化而言,當下的確處于一個比較好的時候。
但許錦波強調,就人工智能預測蛋白質結構而言,重復實現明星公司DeepMind的AlphaFold2不應該成為其他團隊的目標,“這種改進只是一個漸進式的改進,并不是一個非常大的突破,這個領域仍然有一系列問題真正需要我們去解決。”對于人工智能在藥物研發等生命領域的應用,他則表示,“希望能夠做出一些真正有用的東西出來。”
始于半個世紀前的猜測
蛋白質結構預測,始于科學家們的一種設想,是否無需實驗就能獲取蛋白質的三維結構?
在蛋白質結構解析的幾十年歷史中,結構生物學家們用X射線晶體學、核磁共振波譜學(NMR)、冷凍電鏡(Cryo-SEM)技術解析了很多蛋白的結構,并以此更好地推進疾病機理、藥物研發等工作。
然而,這些手段被視作勞心勞力又價格高昂。截至目前,約有10萬個蛋白質的結構已經用實驗方法得到了解析,但這在已經測序的數10億計的蛋白質中只占了很小一部分。
作為學計算機出身的一名科學家,許錦波對他研究了近20年的蛋白質如此理解:蛋白質是由很多氨基酸通過化學鍵串聯在一起,如果把每個氨基酸看成一個珠子的話,那么就有20種不同顏色的珠子,這些珠子串在一起形成蛋白質的氨基酸系列,每一個不同的顏色用一個字母表示,所以蛋白質氨基酸序列可以看成是1個由20個字母組成的字符串。每個氨基酸又是由幾十個原子組成的,所以整個蛋白質是由成千上萬個原子構成的,這些原子在細胞里面有相互作用力,最后形成一個穩定的構型。
“我們可以用不同的軟件去把這些結構給顯示出來,但是在利用這些軟件去顯示蛋白質構型的時候,我們需要知道這些原子在三維空間中的位置,需要知道它們的三維坐標,怎么樣才能知道這些三維坐標?”許錦波提到,在過去很多年里,科學家發展了三種主要的實驗技術,去測定這些原子的三維坐標。
除了上述提到的三種實驗室技術之外,科學家們也在研究,計算方法的推導是否可行?
許錦波對澎湃新聞記者表示,美國生物化學家、1972年諾貝爾化學獎得主克里斯蒂安·安芬森(Christian Boehmer Anfinsen)通過實驗提出了他自己的猜想,“這位實驗學家的猜測基本是對的,他自己做了一些列實驗支持了這個理論。”
安芬森的工作大部分圍繞蛋白質的結構與功能之間的關聯性。1961年,他研究了核糖核酸酶可以在變性后重新進行折疊,恢復到原來的空間結構,同時保留酵素的活性。安芬森因此認為,所有造成最終構象所需的蛋白質信息都被編碼于其氨基酸序列上,即蛋白質一級排序決定三維結構。
上述即被稱為安芬森法則,這也是蛋白質結構預測的基石。

美國生物化學家、1972年諾貝爾化學獎得主克里斯蒂安·安芬森。
然而,在隨后的50多年時間里,科學家們使用了各種各種的方法,都無法精確計算蛋白質的三維結構。“在安芬森這個假設和理論基礎之下,科學家們去做蛋白質折疊預測,都是從能量優化的角度去做。”許錦波解釋,大家普遍認為,蛋白質是折疊到最小能量狀態,這也意味著,從理論上來說,如果能更好地優化這個能量函數,就能夠找到蛋白質的最小能量狀態。
但這一思路有著天然缺陷。“第一,一個蛋白質是一個非常大的體系,由成千上萬個原子組成,對應一個非常巨大的搜索空間,構型是千變萬化的。”許錦波繼續提出第二個困難之處,“雖然說大家普遍接受蛋白質折疊到最小能量狀態,但能量函數到底是什么樣的?我們本身就對能量函數的理解還不是特別好。”
許錦波在博士階段最初也是使用傳統的優化算法去研究這一問題。2001年,他接下了導師向他拋出的這一課題,第二年即取得了不錯的成果,在2002年全球蛋白質結構預測比賽CAFASP(用于全自動高通量蛋白質結構預測的評比)中,奪得冠軍。
回憶當時的成績,許錦波略顯輕描淡寫,“雖然排名最好,但是意義并沒有那么大,并沒有改變這個問題的現狀,只是結果比別人好一點點而已。”在這一思路下繼續了一年多之后,他意識到,傳統的優化算法可能不是一個很好的路徑。
2006年,許錦波開始轉向機器學習,彼時已組建獨立實驗室的他認為,應該改變策略。“我們用機器學習做的比傳統的方法好一點,在蛋白質結構預測比賽中,也取得了很好的成績,比別的組要好一點,但也并沒有特別大的改變。”
這條路徑一走就又是8年,應該也是許錦波科研道路上最冷清的8年,很多人陸續轉行,領域幾無關注。
人工智能為什么可以成功
2014年,許錦波開始第二次轉換途徑。
“2012年,深度學習開始在圖像識別中做到了很好的結果,所以我們在2014年開始嘗試用深度學習去研究這個問題。”真正將AI納入到許錦波預測蛋白質結構的工具箱中,始于這一年。彼時,同領域中只有極少數人關注到這一新的工具。
“新方法不是去做能量最優化,而是預測原子之間的相互作用關系。”
許錦波進一步解釋道,假設已有一個氨基酸序列,那么把和這一蛋白質同源(同一個家族)的那些蛋白質都找出來,然后把所有這些同一個家族的蛋白質的氨基酸序列都比對在一起。“多序列對比下,我們用矩陣去表示蛋白質里面氨基酸之間相互作用關系,然后根據相互作用關系矩陣,就可以把蛋白質的原子的坐標預測出來,這是這種新方法的總體思路。”
當然,在總體思路框架下可以有不同的實現方法,“但新方法的關鍵點在于,我們能不能準確地推斷出蛋白質里面原子之間或者氨基酸之間的相互作用關系,這一步是非常關鍵的。”
許錦波談到,為了預測原子之間的相互作用關系,科學家們探索的最早方法是協同進化全局統計方法(global statistical method for co-evolution analysis)。然而,這種方法只對極少比例蛋白質有效,而往往這些蛋白質家族里某些蛋白的三維結構已經被實驗技術測出來了,這也意味著用這種方法預測的意義并不太大。
他認為,真正對大量的蛋白質結構預測其作用的轉折之年是2016年。在轉向深度學習2年之際,許錦波開始用深度學習預測蛋白質的三維結構。而在此前的2年時間里,其團隊以更為簡單的問題入手,嘗試預測蛋白質的二級結構,即肽鏈主鏈骨架原子的空間位置排布,不涉及氨基酸殘基側鏈。
“對于這么一個簡單的問題能夠做得好,我們認為對于更難的問題,也就是預測蛋白質的三維結構應該會有效果。”許錦波提到一個細節,在2015年其就組織學生去解決三維結構的問題,然而并沒有實現,“他們不太理解我的想法,因為那個時候在這個領域沒有人用深度卷積網絡去解決這個問題。”
2016年,騰出一些時間的許錦波開始自己寫代碼去實現自己的算法,“大概在那年暑假的時候就得到了非常好的結果,發現一下子能做得比以前的方法好非常多,2016年秋天,我把結果寫成一篇論文發布在了網上。”發布后的第一個月,即在領域內引起了一波關注高潮。
許錦波發布的正是他開發的第一代人工智能方法RaptorX。該方法基本的原理是,通過深度卷積殘差網絡(ResNet),對蛋白質的序列進行卷積變換,從中抽取出有效信息,同時也對蛋白質殘基之間相互作用關系進行卷積變換。通過這兩者不同的卷積變換,可以非常準確地預測蛋白質氨基酸之間的相互作用關系。“然后基于這個相互作用關系,我們可以把它的三維結構重構出來。”
在2016年全球蛋白質結構預測比賽(CASP12)中,這一尚未完善好的方法即嶄露頭角,“當時已經做得非常好,做的比其他傳統方法都要好。”

2017年1月,許錦波將前期成果正式發表于《PLOS Computational Biology 》,題為“Accurate De Novo Prediction of Protein Contact Map by Ultra-Deep Learning Model”。在這篇論文中,研究團隊展示了通過使用深度殘差卷積網絡,可以大幅度提高蛋白質預測的精度,并且這種學習方法也很容易推廣到不同類型的蛋白質層面,比如一些膜蛋白及蛋白復合物等的結構。
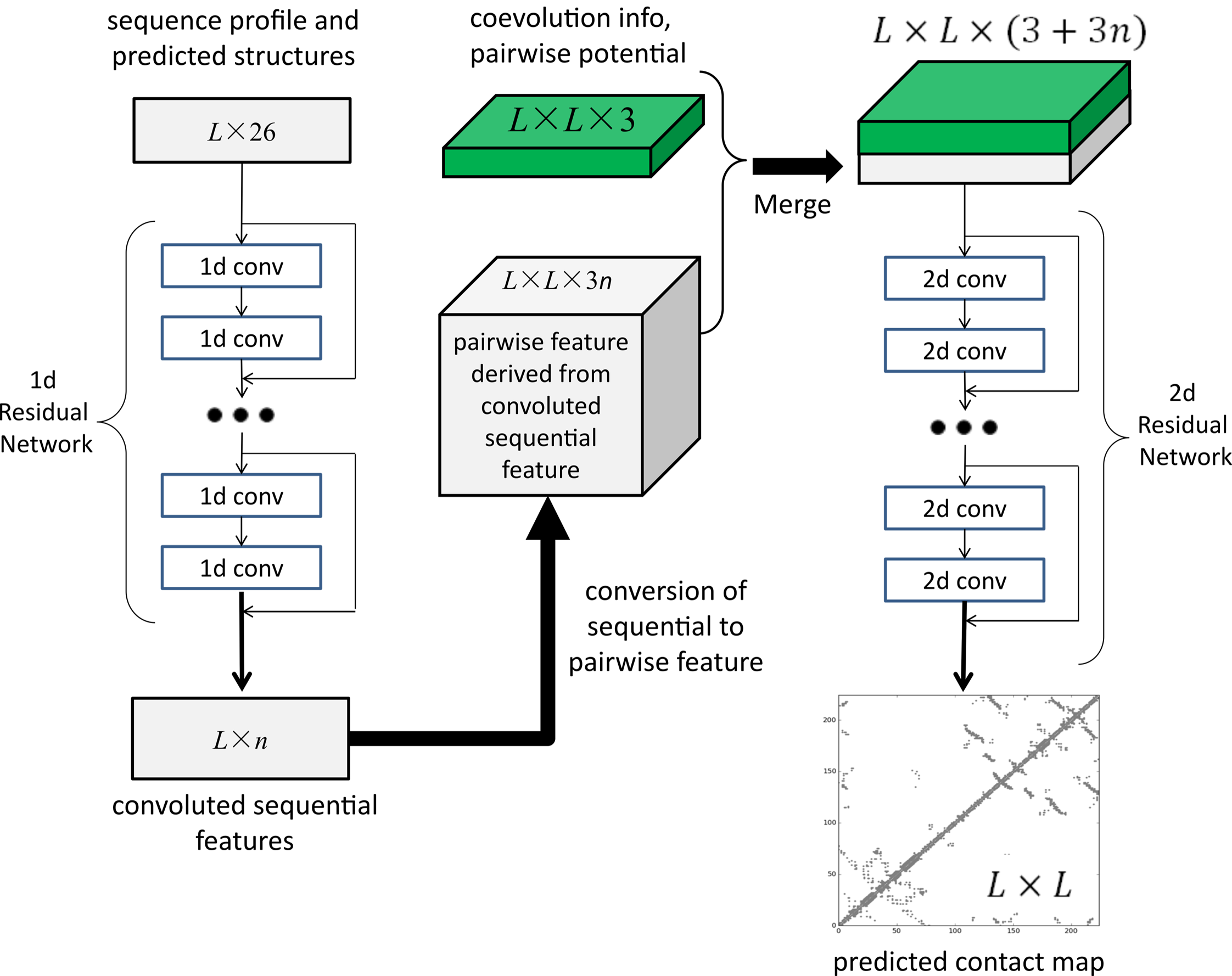
至今這仍是許錦波最滿意的一篇論文。“我們論文出來之后,其實把問題定義得很清楚了。從AI的角度來說,就是告訴大家這個問題的輸入是什么,輸出是什么,你只要把AI算法做好就行了。至于你用什么AI算法,無非更多的是工程上和計算資源上的問題。”
他還向澎湃新聞記者回憶了一段小插曲,研究團隊實際上最開始將論文投到了《自然》(Nature)的一本子刊,然而編輯并不太相信他們的結果。“因為這個問題研究很多年了,一直沒有什么進展,他不認為我們能做得這么好,另外一本期刊的一個評委都不認為我們的結果是可靠的。”
令許錦波欣慰的是,無論是學術界還是產業界,都在論文發表之后對該研究給予了廣泛的關注。他感受到,總體而言,學計算機出身的人更容易接受他們的結果,而學生物化學或者生物物理的人,因為此前就不習慣于使用類似的方法,并不太容易接受這項結果。
值得一提的是,在蛋白質結構預測領域過去近30年的時間里,該領域的發展大致可以分三個階段。第一個階段,也就是長達20多年的時間里,在傳統方法之下該領域進展非常緩慢;第二個階段,也就是通過使用許錦波等人開發的第一代人工智能方法RaptorX,難度較大的蛋白質結構的預測精度已被大幅提升;而在第三個階段,則是目前為止全球表現最好的蛋白質結構預測工具,也就是DeepMind在2020年推出的AlphaFold2。“通過使用注意力機制網絡,又可以大幅度提高蛋白質結構預測的精度。”
在許錦波看來,DeepMind在2017年、2018年之際,實際上在重新實現他的算法,“當然他們工程上做得比我們好一些。”而對于DeepMind在AlphaFold2中使用的注意力機制網絡,其最早被應用于自然語言處理中。
“計算生物學領域的人知道的并不是很多,最早將這一網絡真正用到這個領域的是Facebook,他們沒有用來做蛋白質結構預測,而是用來對蛋白質序列進行建模。”許錦波提到,即使后來計算生物學領域的人注意到了基于注意力機制的網絡,然而該網絡需要太多的計算資源,“學術界沒有人有這么多資源去做這件事情。”
許錦波坦言,其團隊在2020年曾經考慮如何簡化基于注意力機制的網絡,“希望使它能夠在我們的計算資源上跑起來,這是我當時做的事情,因為我們沒有幾百塊GPU(顯卡上的芯片)。”相比之下,背靠谷歌的DeepMind完全沒有這方面的“資源窘境”,可以用很多GPU卡訓練他們的模型。
許錦波認為,從思想創新而言,AlphaFold2邁的這一步并不沒有讓人感到非常吃驚的。“真正吃驚的是他們能夠一下子調動30個人去做這個事情,能夠把它實現得非常好,我覺得這是他們的長處。”
總體而言,人工智能對蛋白質結構預測領域起到了非常大的推動作用,而過去這么多年里,為何又只有深度學習能夠做到?
許錦波分享了他個人的理解,首要的前提是,深度學習是基于現有的理論基礎,特別是進化論。“第一,雖然我們沒有它們的構型,但是我們知道,同一個家族的蛋白質結構應該是很相似的。第二,同一個蛋白里面空間中相鄰的氨基酸互相影響、共同進化,這點也非常重要。”
除理論基礎外,許錦波認為對于訓練深度學習算法而言,數據當然必不可少。“現在我們有了大量的蛋白質序列數據,可以依據同一個家族里面蛋白質的進化關系去推斷原子在空間中的距離,這是非常重要的。另外一個很重要的數據源是我們也有了一些蛋白質結構數據,雖然說沒有那么多,但現在我們至少有一些,那么通過指導深度學習模型去學習氨基酸共進化與原子間中距離的關系。”
比重復實現AlphaFold2更重要的事情
尤其在AlphaFold2出現之后,人工智能預測蛋白質結構這一領域受到了空前的關注,終于“熱鬧”了起來。
許錦波總結認為,人工智能的確顛覆了蛋白質結構預測,而這會帶來非常大的改變,尤其對分子生物學科來說,“我想這個結果現在已經改變了很多分子生物學家的研究范式,以前的分子生物學家基本都基于蛋白質的氨基酸序列去分析蛋白質的功能,現在很多人都開始使用預測的結構去做研究、去分析蛋白質的功能,所以這是一個非常大的研究范式的改變。”
但現在還遠遠沒有到達終點,將來又如何繼續推進人工智能在結構生物學甚至更廣泛的生物學中的應用?
許錦波談道,有很多團隊在致力于重復實現AlphaFold2,“當然這是一條必經之路,但這種改進只是一種漸進式的改進,即使我們能夠做的好一點點,其實也不是一個非常大的突破。”他同時提醒,如果很多團隊或者初創公司一窩蜂去做這件事情,“我覺得有點浪費資源。”
在他看來,那些當下解決得還不夠好的問題,需要去真正地投入更多的精力。
例如,我們能不能對一個孤兒蛋白進行非常準確預測?能不能預測蛋白質的折疊過程,而不僅僅是最后構型?能不能準確預測蛋白質復合物或者一個多域蛋白的結構?能不能預測蛋白質和多肽、DNA或者RNA的相互作用?能不能預測單點或多點突變對一個蛋白質結構和功能的影響?
他對澎湃新聞記者進一步表示,我們對蛋白質結構預測的要求取決于我們的目標。如果目標只是想知道這個蛋白質最終的三維形狀,對于大部分蛋白質來說其實已經做到了這一點。“然而現在我們能做的,就是可以把單個蛋白的結構預測得很好。但是對于蛋白質復合物等更加復雜的情況,人工智能的方法確實能做得比以前好很多,但是還沒有達到讓人非常滿意的狀態,這個方向還需要花更多的時間去研究。”
許錦波同時拋出一個更值得思考的問題,“現在所有的成功方法其實都有點cheating。”這也是一個從原理上即存在的問題。
不難理解,如此說的原因在于,目前的方法需要使用大量的蛋白質同源信息,“能夠找到越多的同源蛋白,這種預測效果越好。如果沒有這部分的信息,現在所有的方法都沒有效果。”許錦波說,在細胞里面,也就是自然界的蛋白質在折疊的時候,“它并不知道同家族到底有哪些蛋白質,它自己能夠折疊出來,它不需要知道有多少‘兄弟姐妹’。”
值得一提的是,許錦波已經回國,并決定將重心轉移到國內。“創新驅動發展戰略是我們國家綜合國力發展的有力保障,”許錦波對澎湃新聞記者表示,“我希望做一些真正原創且能落地的東西出來,推動科研與產業化的融合發展。”
談到“AI+生命科學”的產業應用價值,許錦波表示,目前“AI for Science”的產業化環境很好,特別是“AI for BioTech”。“國家在‘AI for BioTech’領域非常重視,投資機構也非常支持硬科技領域的早期、長期投資。”而從產業角度來講,他認為,由于AI在生物制藥領域為各個環節賦能,幫助行業提升了效率與準確度,因此AI在該領域的產業化也具有很好的前景。
值得關注的是,今年1月,許錦波在北京創立北京分子之心科技有限公司(下稱“分子之心”)。就在4月,該公司宣布已完成數千萬美元天使輪融資,由紅杉中國領投,百度風投、生命園創投基金、NeuX Capital芯航資本 、未來啟創基金等跟投。分子之心稱,該輪融資將用于進一步擴大團隊、AI蛋白質平臺的持續進化,以及科研成果的產品化轉化。
他對澎湃新聞記者表示,公司目前僅有一個很小的團隊在繼續研究蛋白質結構預測的問題,“我們更主要的目標在于,能不能做各種蛋白質的優化和設計。比如可以把一個抗體優化得更好,使得它能夠跟抗原結合更好;或者說能不能設計一個自然界不存在的蛋白,用它來做藥或用于其他目的;或者能不能把某一個酶優化得更好。這是現在我們公司的重點。”
其最后談到,當下多學科的融合比以往更加重要,而如何吸引更多的人加入到交叉學科,同時也吸引更多的學生進入到領域內,這些仍面臨一些挑戰。
許錦波以其自身經歷說道,“剛進入計算生物學這個領域的時候,我會發現我跟生物學家們的溝通其實是非常困難的。只有經過一段時間之后,談話和合作才能繼續下去,多溝通多交流,我想這是非常重要的。”
而更為關鍵的一點是,他認為評估體系應當做出一些改變。“從我的經歷來看,做蛋白質結構預測或者說做計算生物學,以前其實不太受重視。之前論文都發表不到特別高影響因子的刊物上,而影響因子又跟這個領域多少人在做有關系。如果你用影響因子去評估一項計算生物學的工作的話,往往這些人是比較吃虧的,也進而打壓了那些做計算生物學的學生。”
許錦波的觀點是,大家應當以比較開放的心態,容忍不同領域人的發展。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




