- +1
新冠不能感染小鼠?中國團隊首次發(fā)現(xiàn)貝塔變體能感染標準小鼠
SARS-CoV-2感染受體為人血管緊張素轉(zhuǎn)化酶(hACE2),由于與hACE2存在關鍵氨基酸位點差異,小鼠ACE2(mACE2)不能介導病毒入侵,因此SARS-CoV-2的原始毒株并不能感染普通小鼠模型。而此前科學界用于評估抗病毒藥物或醫(yī)療療效的大SARS-CoV-2感染小鼠模型,都是基于昂貴的表達人類ACE2 (hACE2)的轉(zhuǎn)基因小鼠。
最新的一項研究則發(fā)現(xiàn),新出現(xiàn)的501Y.V2變體(也被稱為貝塔變體)能夠在鼻內(nèi)滴注后感染標準實驗室小鼠。北京時間9月4日,綜合性學術(shù)期刊《國家科學評論》(National Science Review, NSR)在線發(fā)表了軍事科學院軍事醫(yī)學研究院病原微生物生物安全國家重點實驗室秦成峰研究員、中山大學有害生物控制與資源利用國家重點實驗室吳仲義教授領銜完成的一項研究,題為《在SARS-CoV-2進化過程中跨物種傳染性的短暫獲得》(“Transient acquisition of cross-species infectivity during the evolution of SARS-CoV-2”)。

COVID-19大流行持續(xù)已近兩年,在SARS-CoV-2的全球傳播過程中,病毒基因組的突變逐漸積累,導致病毒變異體的出現(xiàn)。501Y.V1、501 Y.V2和501Y.V3(也分別被稱為阿爾法、貝塔和伽馬變體)相繼出現(xiàn),并在世界范圍內(nèi)廣泛傳播。
所有這三種SARS-CoV-2變體都包含S蛋白的特定氨基酸突變,并且在S蛋白的受體結(jié)合域(RBD)中共享一個氨基酸突變N501Y。RBD則與人細胞上的血管緊張素轉(zhuǎn)換酶2(ACE2)特異性結(jié)合,介導SARS-CoV-2宿主細胞的進入。
早在去年7月,秦成峰等人在《科學》(Science)上的一項研究首次記錄到,新冠病毒在小鼠體內(nèi)傳代過程中發(fā)生了N501Y突變,由此產(chǎn)生的小鼠適應株MASCp6和MASCp36完全能夠感染標準實驗室小鼠。這一現(xiàn)象顯然和上述的原始新冠病毒分離毒株不同。
最重要的是,他們和其他團隊一些研究也已經(jīng)證明,N501Y突變顯著增強了新冠病毒RBD與小鼠ACE2的結(jié)合親和力,從而導致小鼠獲得性感染和致病性表型。
然而,秦成峰等人提到,自然發(fā)生包含這種獨特的N501Y突變的新冠病毒變異體(501Y.V1、501 Y.V2和501Y.V3)是否獲得了感染小鼠的能力,這仍有待確定。
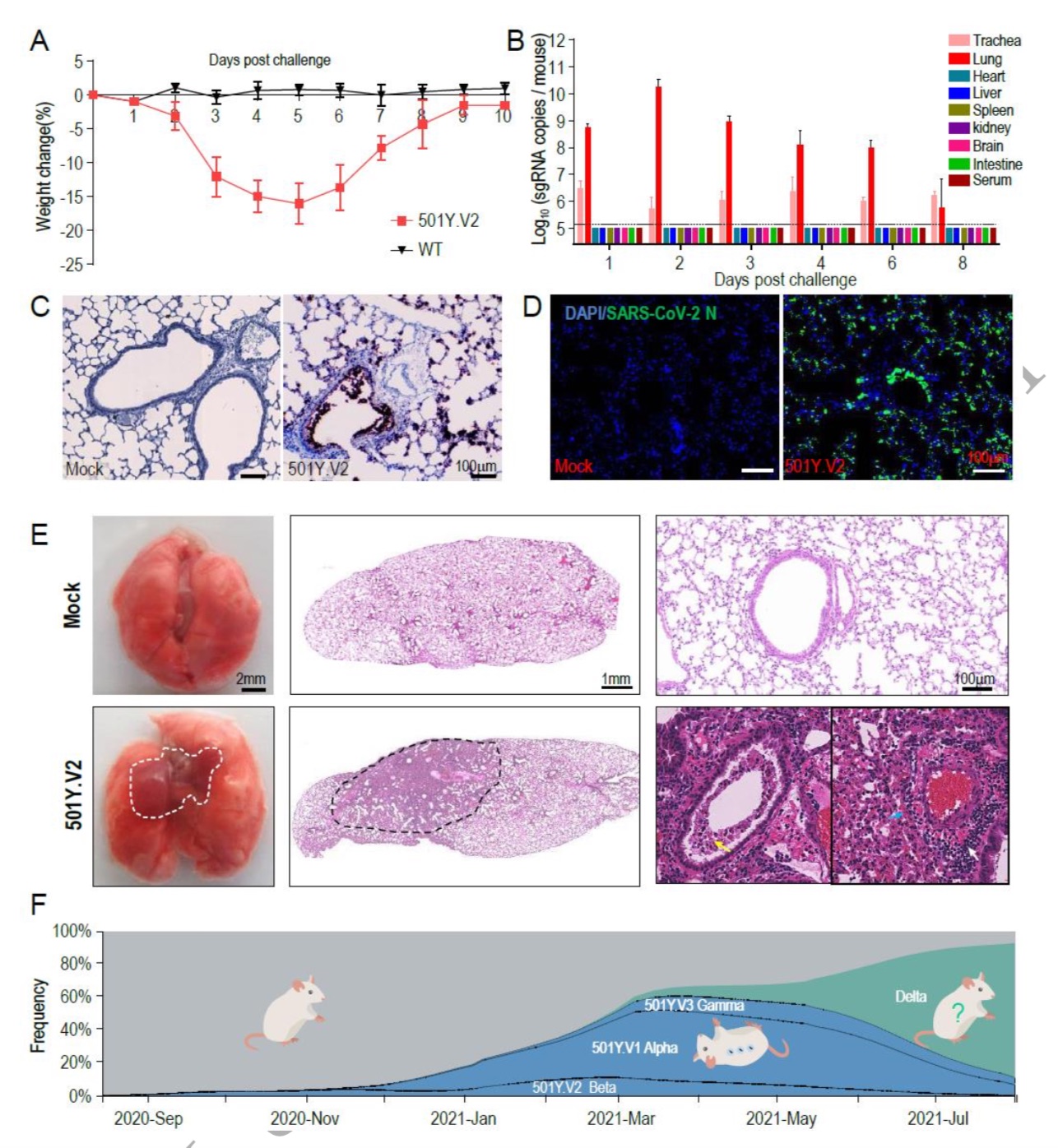
在這項最新的研究中,研究團隊采用了501Y.V2變體(從一例南非輸入性病例中分離),用于檢測小鼠的傳染性。同時以COVID-19大流行早期分離的SARS-CoV-2臨床毒株IME-BJ05(野生型,WT)作為對照毒株。9月齡雌性BALB/c小鼠經(jīng)鼻內(nèi)注射上述不同毒株,劑量為1.2×10^4 pfu。
值得注意的是,所有501Y.V2變體感染的小鼠在感染后第3天開始出現(xiàn)皺毛、駝背姿勢和活動減少等現(xiàn)象,在感染后4-6天體重也下降。這些感染小鼠最終康復,觀察期間無死亡病例發(fā)生。和預期一致的是,感染原始毒株的小鼠均為出現(xiàn)上述現(xiàn)象。
為了描述病毒在小鼠中的復制動態(tài),研究團隊收集了主要組織和血清。SARS-CoV-2亞基因組RNA (sgRNA)定量顯示,501Y.V2感染小鼠肺組織中病毒RNA豐度最高,在感染后的頭2天有明顯的增加趨勢。病毒sgRNA在感染后第8天仍可在氣管中檢測到。然而,在其他組織或血清中沒有檢測到sgRNA。
采用RNAScope方法進行的原位雜交(ISH)試驗顯示,病毒RNA主要位于沿氣道和肺泡壁的細胞中。肺切片免疫染色顯示,SARS-CoV-2 N蛋白主要表達于細支氣管上皮細胞和肺泡細胞。這與ISH結(jié)果一致。
研究團隊還提到,更重要的是,在501Y.V2感染試驗下,尸檢顯示小鼠有可見的肺損傷,表現(xiàn)為肺腫大和局部肺門周圍實變。肺切片顯微鏡觀察也顯示,肺損傷主要發(fā)生在肺門周圍區(qū)域,其特征是細支氣管中大量脫皮壞死的上皮細胞、散在性出血,融合的肺泡壁內(nèi)炎性細胞浸潤。免疫組化染色顯示,浸潤炎癥細胞主要為Neu+中性粒細胞、CD68+巨噬細胞和CD3+T細胞。
最后,在感染后第6天和第8天檢測到SARS-CoV-2特異性IgG和中和抗體。
研究團隊認為,綜上所述,這些結(jié)果清楚地表明,501Y.V2已獲得在小鼠呼吸道復制的能力,并誘導典型的肺損傷和病毒特異性免疫反應。
他們強調(diào),這項研究提供了實驗證據(jù),即501Y.V2變種完全能夠感染標準實驗室小鼠。鼻內(nèi)感染后,501Y.V2能導致老齡小鼠體重顯著下降,501Y.V2的毒性高于小鼠適應株MASCp6,但該變體的致死率低于MASCp36。
研究團隊提到,與他們此前研究的小鼠適應株MASCp6相比,501Y.V2在RBD中攜帶兩個額外的突變(K417N和E484K)。此前的結(jié)構(gòu)和親和性分析表明,K417N和E484K突變都有助于增強小鼠ACE2的親和性。最近的一項研究也表明,在含有N501Y、K417N和E484K突變的ACE2表達小鼠細胞中,偽型SARS-CoV-2的傳染性是含有單個N501Y突變的SARS-CoV-2的4倍。而小鼠適應株MASCp36在RBD中則含有三個K417N/Q493H/N501Y突變,與小鼠ACE2的結(jié)合親和力高于501Y.V2和MASCp6的RBD。
他們表示,實驗中觀察到的501Y.V2以及小鼠適應株的傳染性,是與病毒RBD和小鼠ACE2之間的相互作用密切相關。此外,研究團隊稱,不能排除RBD之外的其他突變的影響,需要用反向遺傳工具進一步驗證。
他們總結(jié)稱,與原始SARS-CoV-2分離毒株相比,501Y.V2以及其他帶有N501Y突變的變種,顯然已經(jīng)獲得了將其宿主范圍擴展到一種新物種小鼠的能力。當然,值得提醒的是,這項實驗結(jié)果是基于實驗室小鼠和相對較高的攻毒劑量,尚沒有證據(jù)表明501Y.V2能夠在小鼠中自然傳播。
值得關注的是,COVID-19以來,我們已經(jīng)知道,貓、水貂、獅子和老虎中均有SARS-CoV-2檢測呈陽性的案例,并且也有證據(jù)表明SARS-CoV-2在水貂養(yǎng)殖場中人-動物-人的雙向傳播。因此,研究團隊提醒,有必要對野生小鼠中的SARS-CoV-2及其變異體進行分子和血清流行病學調(diào)查。
研究團隊最后還提到一點,這項研究還為評估抗SARS-CoV-2的抗病毒藥物和疫苗的體內(nèi)療效提供了一個更便宜和更容易獲得的平臺。以前大多數(shù)SARS-CoV-2感染小鼠模型都是基于昂貴的表達人類ACE2 (hACE2)的轉(zhuǎn)基因小鼠,“然而,在世界范圍內(nèi),幾乎任何數(shù)量的實驗室小鼠標準品系都很容易獲得,而且相對便宜。”
研究團隊認為,這種基于501Y.V2的小鼠模型將為潛在的COVID-19治療藥物和疫苗候選的體內(nèi)篩選和驗證打開新一扇大門。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務許可證:31120170006
增值電信業(yè)務經(jīng)營許可證:滬B2-2017116
? 2014-2024 上海東方報業(yè)有限公司




